PERIOODILISUSTABEL KUI TÖÖVAHEND
Metallid, poolmetallid ja mittemetallid
Poolmetallid on toatemperatuuril tahked, kuid kergesti purunevad ained (nt räni Si), mis asuvad perioodilisustabelis metallide ja mittemetallide vahel poolitades tabelit diagonaalina.
Mittemetallid on reaktsioonis elektrone liitvad elemendid, mis on haprad ning ei juhi elektrit. Mittemetallid on gaasid (hapnik, kloor, lämmastik) või tahked ained (süsinik, väävel, fosfor), vaid broom on toatemperatuuril vedel. Peale vesiniku asuvad kõik mittemetallid tabelis poolmetallidest moodustunud diagonaalist paremal.
Metall on reaktsioonis elektrone loovutav element, mille lihtainel on metallilised omadused. Metallidele on iseloomulik metalne läige, hea elektri-ja soojusjuhtivus ning vormitavus. Metallid on tahked, vaid elavhõbe on toatemperatuuril vedelas olekus.
Sulle võivad huvi pakkuda need õppematerjalid:
Jäätmed pole kõigest prügi
Loodusõpetuse tööraamat 6. klassile. I osa
Loodusõpetuse tööraamat 6. klassile. II osa
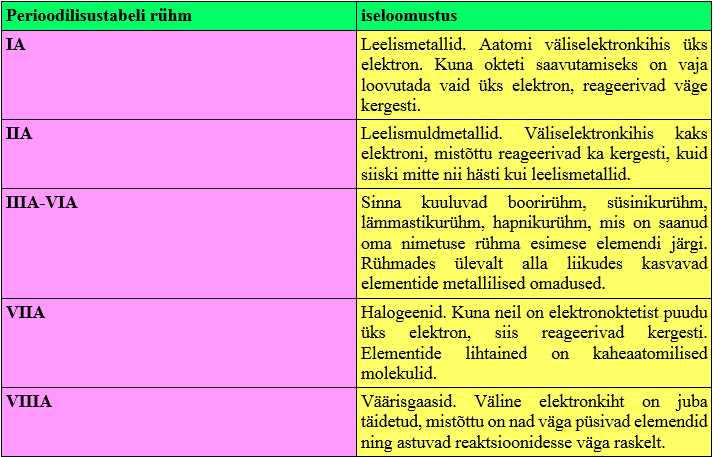
Väline elektronkiht
Väline elektronkiht ehk aatomituumast kõige kaugemal asuv elektronkiht määrab ära antud elemendi lihtaine omadused. Seda sel põhjusel, et elementide aatomid püüdlevad püsivama oleku ehk täielikult täidetud väliselektronkihi poole. Kui aatomi väliselektronkihis on kaheksa elektroni, on tegemist elektronoktetiga. Elektronokteti saavutamiseks liidavad, loovutavad ja jagavad aatomid elektrone. Mittemetallidel on välisel elektronkihil palju elektrone, mistõttu on neil oktetti lihtsam saavutada elektrone liites, metallidel on väliskihis vähe elektrone ja seetõttu on neil loovutades lihtsam oktetti saavutada.
Kuna perioodilisustabelis paiknevad ühes rühmas elemendid, millel on aatomite väliskihil ühepalju elektrone, siis on nende lihtainetel ka sarnased omadused.
Punktmudel näitab elemendi tähist ja aatomi väliskihi elektronide arvu.
B-rühmades on siirdemetallid, mille väliselektronkihil on enamasti 1-2 elektroni, mis reageerides loovutatakse.