2.8. Aatomite elektronkonfiguratsioon
Elektronkonfiguratsioon kirjeldab elektronide paiknemist aatomis; kasutatakse ka sõna „elektronstruktuur“.
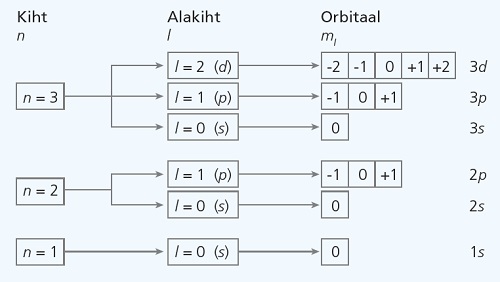
Elektronkihid jagunevad alates teisest kihist alakihtideks, mida tähistatakse tähtedega s, p, d, f. Alakihtide arv mingil kihil võrdub kihi numbriga. Alakihile vastavaid orbitaale tähistatakse vastava tähega, mille ees on kihi number: näiteks 2s tähistab 2. kihi s-orbitaali.
| Kihi number | Alakihid | Alakihi orbitaalide arv | Maksimaalne $\ce{e^-}$ arv alakihis | Maksimaalne $\ce{e^-}$ arv kihil |
|---|---|---|---|---|
| 1. | 1s | 1 | 2 | 2 |
| 2. | 2s 2p | 1 3 | 2 6 | 8 |
| 3. | 3s 3p 3d | 1 3 5 | 2 6 10 | 18 |
Elektronkihid ja alakihid ei määra mitte ainult elektroni kaugust aatomituumast, vaid ka nende energiat. Aatomi põhiseisundis on elektronid võimalikult madalamatel energiatasemetel, st elektronid paigutuvad kihtidele ja alakihtidele energia kasvu järjekorras.
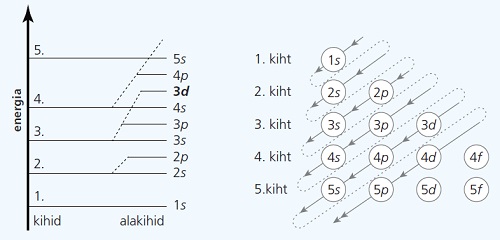
Alakihtide elektronidega täitumise järjekord on järgmine: $1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s …$
Kihtide ja alakihtide energia kasvu järjekorda iseloomustab alltoodud diagramm. Sageli kujutatakse seda ka diagrammi kõrval toodud skeemiga, kus ridades on näidatud kihtide alakihid, energia kasv toimub aga näidatud diagonaale pidi.
Arvestades, et kõik elektronkihid algavad s-orbitaaliga, on perioodide alguses alati kaks s-elementi (viimasena täitub väliskihi s-orbitaal).
Enne elektronide paigutumist järgmise kihi s-orbitaalidele (s-orbitaaliga algab uus periood) täituvad eelmise kihi p-orbitaalid, seega on perioodide lõpus alati kuus p-elementi (viimasena täituvad väliskihi p-orbitaalid).
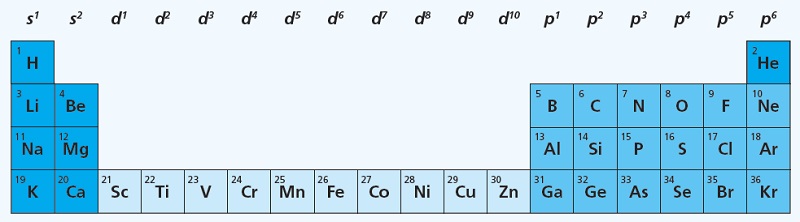
Kuna elektronide paigutumine d-orbitaalidele toimub pärast järgmise kihi s-orbitaalide täitumist, on s- ja p-elementide vahel alates 4. perioodist d-elemendid (viimasena täituvad eelviimase kihi d-orbitaalid). d-elemente nimetatakse ka siirdemetallideks.
Elektronvalem väljendab elektronide jaotumist alakihtidele.
Elektronvalemi koostamine
- Leiame perioodilisussüsteemist elemendi elektronide koguarvu (= aatomnumber).
- Arvestades, et s-orbitaal mahutab kuni 2 elektroni, p-orbitaalid kuni 6 elektroni ja d-orbitaalid kuni 10 elektroni, hakkame kirjutama elektronide arve alakihtide elektronidega täitumise järjekorras alakihtidele (elektronide arv kirjutatakse vastava orbitaali tähise astendajaks). Kui kõik elektronid on paigale pandud, ongi elektronvalem valmis.
Märkus. Pane tähele, kui elektronskeemis võivad olla lõpuni elektronidega täitumata viimane ja
eelviimane kiht, siis elektronvalemis võib jääda poolikuks ainult viimasena täituv alakiht.
Kuna elemendi aatomi täielikult täitunud elektronkihtide konfiguratsioon vastab elemendile perioodilisustabelis eelneva väärisgaasi elektronkonfiguratsioonile, siis võib elektronvalemeid lühendada vastava väärisgaasi nurksulgudes tähise märkimisega täielikult täitunud elektronkihtide asemele.
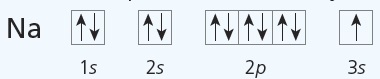
$\ce{Na}(+11): 1s^22s^22p^63s^1$ ehk $\ce{Na}(+11): \ce{[Ne]}3s^1$
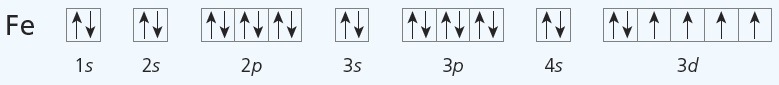
$\ce{Fe}(+26): 1s^22s^22p^63s^23p^64s^23d^6$ ehk $\ce{Fe}(+26): \ce{[Ar]}4s^23d^6$
Ruutskeem iseloomustab elektronide täpsemat jaotumist orbitaalidel. Ruutskeem koostatakse elektronvalemi alusel. Seejuures tuleb arvestada, et üht tüüpi orbitaalide (võrdse energiaga orbitaalide) täitumisel paigutub kõigepealt igale orbitaalile üks elektron ja alles siis teine; paardumata elektronid on samasuunalise spinniga (st noolekesed peavad olema joonistatud samas suunas).
Näiteks eespool koostatud $\ce{Na}$ ja $\ce{Fe}$ elektronvalemite põhjal saab koostada vastavad ruutskeemid.
Märkus. Ruudukesed võib kirjutada ühele kõrgusele (energia kasvab vasakult paremale) või üksteise kohale (energia kasvab alt üles).
A-rühmade elementide ioonide elektronvalemi koostamisel on mõistlik koostada esmalt aatomi elektronvalem ning siis arvestada, mitu elektroni aatom liidab väliskihile või loovutab väliskihilt (et saada sinna 8 või teatud juhtudel 2 elektroni).
Aatom $\ce{Na}: 1s^22s^22p^63s^1$ on metall $\ce{->}$ loovutab väliskihilt 1 elektroni $\ce{->}$ katioon $\ce{Na^+}: 1s^22s^22p^6$
Aatom $\ce{S}: 1s^22s^22p^63s^23p^4$ on mittemetall $\ce{->}$ liidab väliskihile 2 elektroni $\ce{->}$ anioon $\ce{S^{2-}: 1s^22s^22p^63s^23p^6$
B-rühmade elemendid loovutavad alati kõigepealt 2 väliskihi s-elektroni (seepärast ongi neil tavaliselt üheks o.a II) ja alles seejärel mingi arvu eelviimase kihi elektrone d-orbitaalidelt. Tavaliselt loovutatakse d-orbitaalidelt niipalju elektrone, et d-orbitaalid oleks tühjad või pooltühjad (igal orbitaalil üks elektron).
Aatom $\ce{Fe}: 1s^22s^22p^63s^23p^6\textbf{4s}^23d^6$
Ioon $\ce{Fe^{2+}}: 1s^22s^22p^63s^23p^63d^6$ (aatom loovutas väliskihilt kaks s-elektroni)
Ioon $\ce{Fe^{3+}}: 1s^22s^22p^63s^23p^63d^5$ (aatom loovutas lisaks veel ühe d-elektroni; nüüd on d orbitaalid pooltühjad, st seal on 5 elektroni)
Täiendav selgitus. Kirjeldatud aatomite elektronkonfiguratsioonid tulenevad kvantmehaanilisest aatomimudelist, mis toetub Erwin Schrödingeri lainevõrrandile. Aatomorbitaalid on elektronide lainefunktsioonid, mis on täielikult kirjeldatavad nelja kvantarvu abil:
- peakvantarv n määrab elektronkihi; $n$ väärtusteks on 1, 2, 3 jne, mis vastavad elektronkihtide järjenumbritele;
- orbitaalkvantarv $l$ määrab alakihi (s, p, d, f); l väärtusteks on 0, 1, 2 kuni $n-1$, kusjuures $l$ väärtusele 0 vastab s-alakiht, $1 \ce{->} p, 2 \ce{->} d$ ja $3 \ce{->} f$;
- magnetkvantarv ml määrab samal alakihil konkreetse aatomorbitaali; $m_l$ võimalikud väärtused on täisarvud $-l$ ja $+l$ vahel, nt kui elektron on p-orbitaalil, siis $l=1$ ja tema ml võib olla kas –1, 0 või 1, mis vastavad kolmele erinevalt suunatud p-orbitaalile;
- spinnkvantarv ms määrab elektroni spinnoleku; $m_s$ võib omada vaid kahte väärtust (kas $\ce{-1/2}$ või $\ce{+1/2}$), mistõttu võib igal orbitaalil olla korraga kuni kaks elektroni; kui ülejäänud kolm kvantarvu määravad ära energiatasemed ja alatasemed ning elektroni tõenäosuspilve, siis spinnkvantarvu võrreldakse sageli elektroni pöörlemissuunaga.