2.2. Elektronkatte ehitus
Elektronkate koosneb elektronkihtidest. Elektronide maksimaalset arvu kihil saab arvutada valemiga $2n^2$, kus n on elektronkihi number. Seega võib esimesel kihil olla kuni 2 elektroni, teisel kihil kuni 8 elektroni, kolmandal kihil kuni 18 elektroni ja neljandal kihil kuni 32 elektroni. Väliskihil võib olla kuni 8 elektroni ja eelviimasel kihil kuni 18 elektroni.
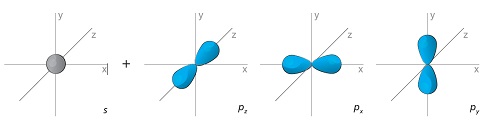
Elektronkihid jagunevad alates teisest kihist alakihtideks. Elektroni keeruka liikumise tulemusena moodustub elektronpilv. Igale alakihile vastab kindla kujuga aatomorbitaal. Aatomorbitaal on ruumiosa, kus elektron viibib kõige sagedamini, st elektroni leidumise tõenäosus on seal kõige suurem. s-orbitaal on kerakujuline, p-orbitaal on ruumilise kaheksa kujuline. s-orbitaale on igal kihil üks. p-orbitaale on alates teisest kihist igal kihil kolm ja nad paiknevad üksteise suhtes risti (mööda koordinaattelgi). Veel keerukama kujuga on d– ja f-orbitaalid.
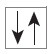
Ühele orbitaalile mahub kuni kaks vastassuunaliste spinnidega elektroni. Spinni kujutati algselt ette kui elektroni pöörlemissuunda; tänapäeval seostatakse spinni elektroni magnetiliste omadustega.
Orbitaale kujutatakse sageli ruudukestena ja elektrone neil noolekestena. Orbitaalil võib olla:
$\ce{0 e^-}$ – tühi orbitaal
$\ce{1 e^-}$ – paardumata (üksik) elektron
$\ce{2 e^-}$ – elektronipaar (vastassuunaliste spinnidega)