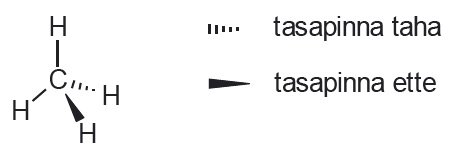1. Süsinikuühendite struktuuri kujutamine
Mis keemiliste elementide aatomid on orgaaniliste ainete molekulides kõige levinumad?
Orgaanilisteks aineteks nimetatakse üldiselt süsinikuühendeid, mis sisaldavad $\ce{C-H}$ sidet. Neli levinumat keemilist elementi, mille aatomid esinevad orgaaniliste ainete molekulides, on süsinik $\ce{(C)}$, vesinik $\ce{(H)}$, hapnik $\ce{(O)}$ ja lämmastik $\ce{(N)}$. Lisaks võivad orgaaniliste ainete molekulid sisaldada väävli $\ce{(S)}$, fosfori $\ce{(P)}$, halogeenide $\ce{(F, Cl, Br, I)}$ ja teiste keemiliste elementide aatomeid.
Nelja levinuma keemilise elemendi aatomite esinemiskujud orgaanilistes molekulides on koondatud tabelisse.
Piir orgaaniliste ja anorgaaniliste ainete vahel on kokkuleppeline. Enamasti loetakse ka $\ce{CCl_4}$ orgaaniliseks aineks, kuigi selles puuduvad $\ce{C-H}$ sidemed. Süsiniku oksiidid, süsihape ja selle soolad liigitatakse anorgaaniliste ainete hulka.
| Keemiline element | Süsinik $\ce{C}$ | Lämmastik $\ce{N}$ | Hapnik $\ce{O}$ | Vesinik $\ce{H}$ |
|---|---|---|---|---|
| iseloomulik kovalentsete sidemete arv | neli | kolm | kaks | üks |
| täppskeem (väliskihi elektronid) |  |  |  | $\ce{H.}$ |
| aatomite esinemiskujud | neli üksiksidet*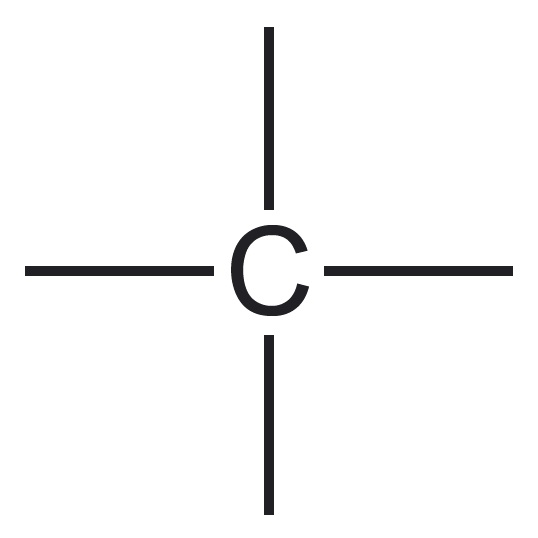 üks kaksikside, kaks üksiksidet 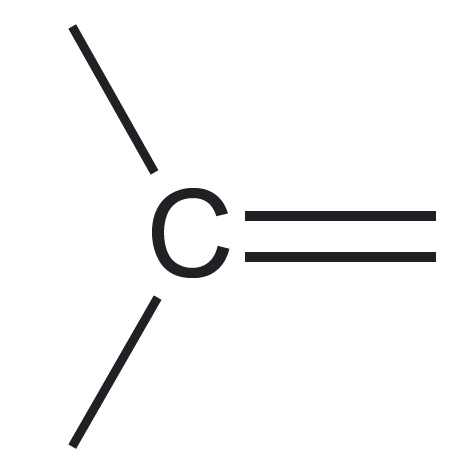 üks kolmikside, üks üksikside $\ce{-C#}$ kaks kaksiksidet $\ce{=C=}$ | kolm üksiksidet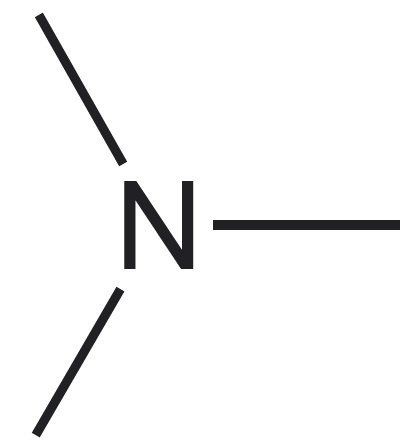 üks kaksikside, kaks üksiksidet 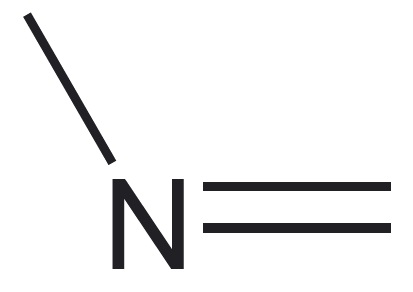 üks kolmikside $\ce{N#}$ | kaks üksiksidet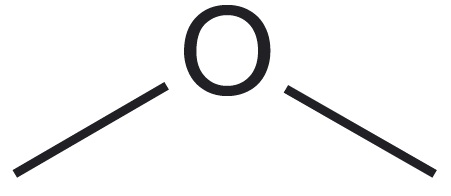 üks kaksikside $\ce{O=}$ | üks üksikside $\ce{H-}$ |
* Üksikside on kahe aatomi vaheline kovalentne side, mille moodustab üks ühine elektronipaar; kaksiksideme moodustab kaks ühist elektronipaari ning kolmikside kolm ühist elektronipaari.
Halogeenide aatomitele on iseloomulik moodustada orgaaniliste ainete molekulides üks kovalentne side.
Millise kujuga võivad olla süsinikahelad?
Süsiniku aatomid moodustavad omavahel ühinedes erineva pikkusega püsivaid ahelaid. See on üks süsinikuühendite paljususe põhjustest. Teiste keemiliste elementide aatomitele selline omadus iseloomulik ei ole.
Eristatakse hargnemata (lineaarset), hargnenud ja tsüklilist süsinikahelat.
| Süsinikahela kuju | Hargnemata | Hargnenud | Tsükliline |
|---|---|---|---|
| näide orgaanilisest ühendist | 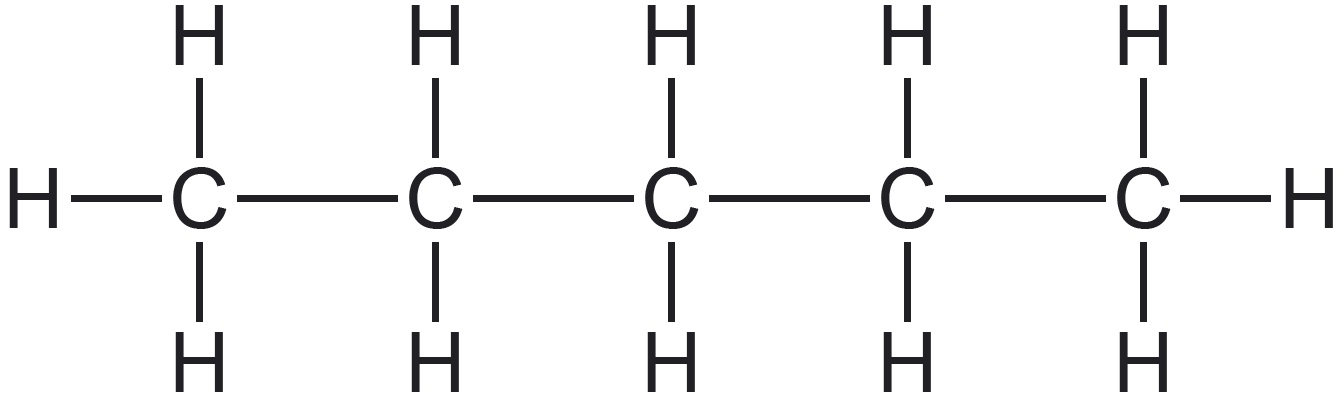 | 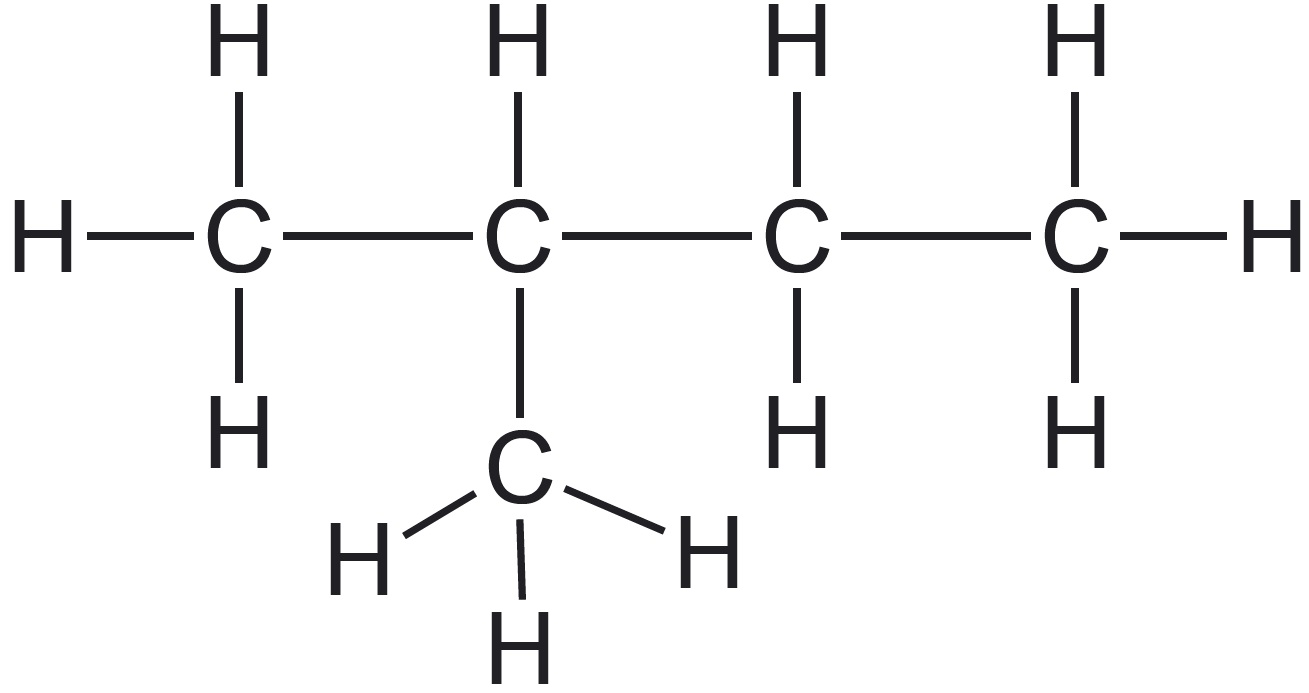 | 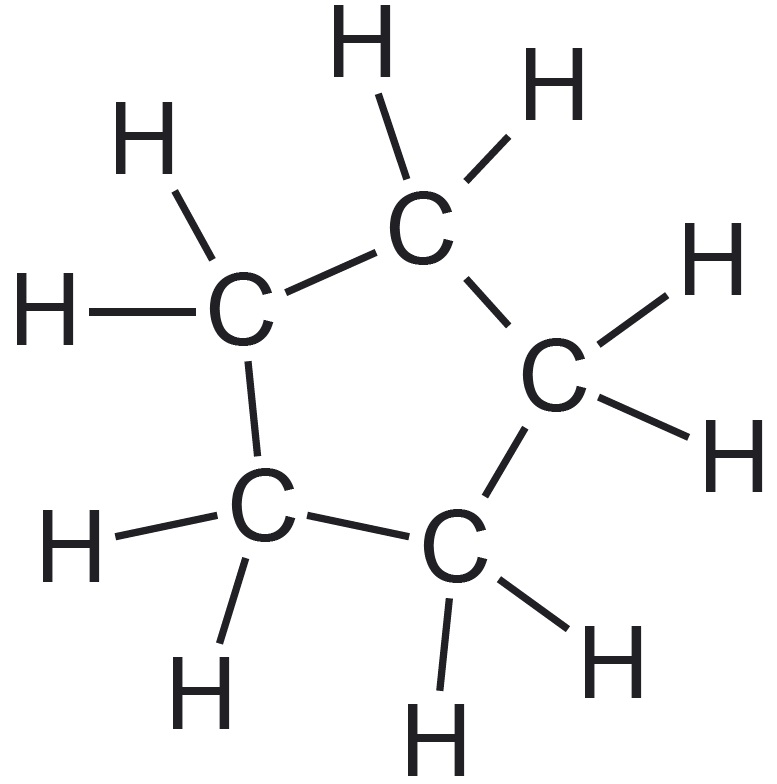 |
| süsinikahela kuju selgitus | iga süsiniku aatom (v.a otsmised aatomid) on seotud vaid kahe süsinikuaatomiga | üks või enam süsiniku aatomit on seotud kolme või nelja süsiniku aatomiga | süsinikahel on „kinnine“ ehk „suletud“ |
Kuidas väljendatakse molekulide koostist ja ehitust?
Molekulide koostise ja ehituse väljendamiseks kasutatakse erinevaid valemeid. Vaatleme esmalt erinevat tüüpi (struktuuri-) valemeid heksaani näitel.
Heksaan on süsivesinik, mille molekulis on kuus süsiniku aatomit, kusjuures aatomite vahel esinevad vaid üksiksidemed. Heksaan on üks mootorikütuse bensiini komponente. Heksaani kui mittepolaarset lahustit kasutatakse toiduõlide eraldamiseks seemnetest, nt soja- ja päevalilleõli tootmisel. Järgnevas tabelis on esitatud kolm peamist struktuurivalemi tüüpi ehk viisi, kuidas kujutada orgaanilise ühendi molekuli ehitust (struktuuri).
| Väljendusviis | Näide: heksaan |
|---|---|
| Tasapinnaline ehk klassikaline struktuurivalem näitab kõiki molekuli koostises olevaid aatomeid vastavate elementide tähistega ja kõiki nendevahelisi sidemeid sirglõikudega (kriipsukestega). | 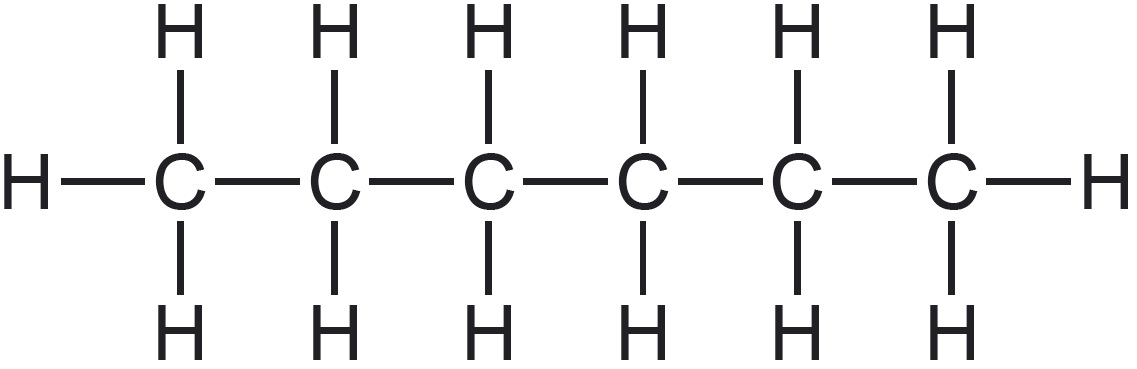 |
| Lihtsustatud struktuurivalemis võetakse kokku iga süsiniku juurde kuuluvad aatomid või aatomite rühmad; tavaliselt kujutatakse välja süsinikevahelised kordsed sidemed (mõnikord näidatakse ka süsinikevahelised sidemed). Lihtsustatud struktuurivalemis võib molekuli ehituses korduva lõigu kirjutada sulgudesse ja märkida indeksiga korduvuste arvu. | $\ce{CH_3-CH_2-CH_2-CH_2-CH_2-CH_3}$ ehk $\ce{CH_3CH_2CH_2CH_2CH_2CH_3}$ ehk $\ce{CH_3(CH_2)_4CH_3}$ |
| Graafilise kujutise korral tähistab sirglõik kovalentset sidet ning süsiniku aatomid ja nendega seotud vesiniku aatomid jäetakse märkimata. See tähendab, et iga sirglõigu ots ja murdekoht märgibki süsiniku aatomit koos tema juurde kuuluvate vesiniku aatomitega. Teiste elementide (nt O, N…) aatomid kirjutatakse välja koos nendega seotud vesiniku aatomitega. Graafilise kujutise aluseks on süsinikahela projektsioon tasapinnale. Selle selgituseks on lisatud heksaani molekulimudel ja lihtsustatud struktuurivalem, mis annab paremini edasi süsiniku aatomite vahelisi nurki heksaani molekulis. | 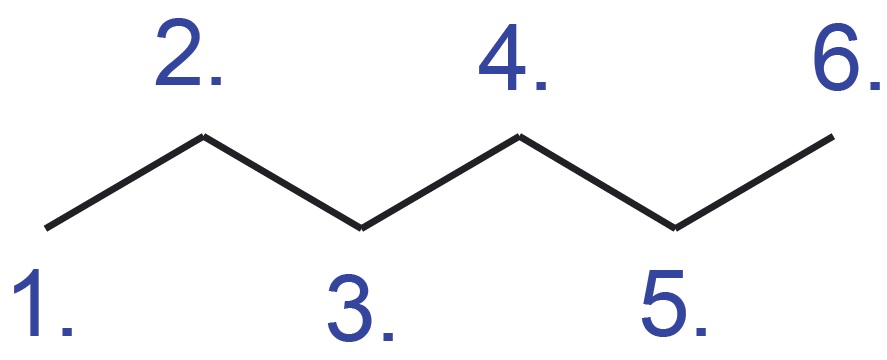 Selgitus: Selgitus: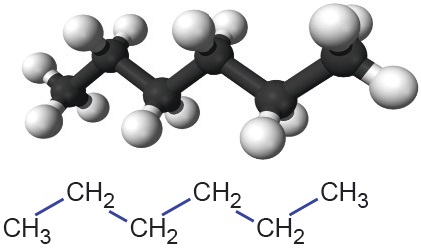 |
Summaarne (molekuli)valem ehk brutovalem näitab, mitu vastava keemilise elemendi aatomit ühendi molekulis kokku on. Heksaani summaarne valem on $\ce{C_6H_{14}}$.
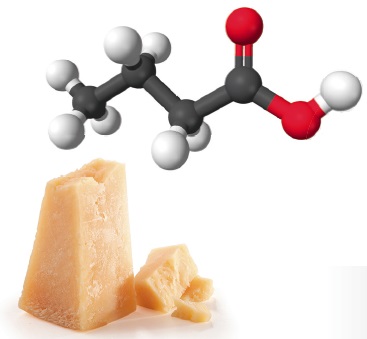
Vaatleme veel kahe mõnevõrra keerulisema ehitusega molekuli struktuuri kujutamisvõimalusi. Teeme seda hargnenud süsinikahelaga süsivesiniku 2,4-dimetüülpentaani ja karboksüülhappe butaanhappe näitel. Selguse mõttes on 2,4-dimetüülpentaani tasapinnalises ja lihtsustatud struktuurivalemis esitatud peaahelasse mittejäävad aatomirühmitused värviliselt. Butaanhappe rahvapärane nimetus võihape viitab sellele, et see eraldati esmakordselt võist. Võihape on spetsiifilise ebameeldiva lõhnaga. Butaanhapet sisaldab näiteks Parmesani juust.
| Väljendusviis | 2,4-dimetüülpentaan | Butaanhape |
|---|---|---|
| tasapinnaline struktuurivalem | 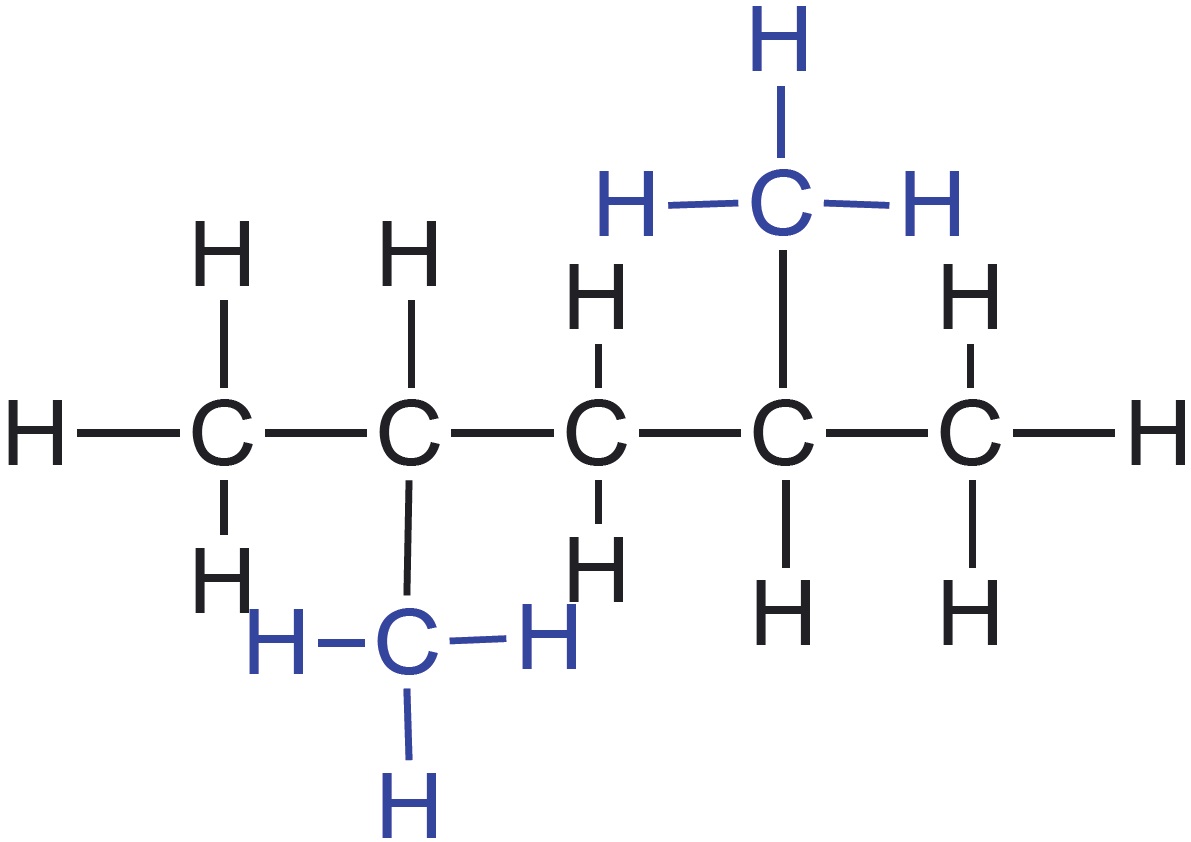 | 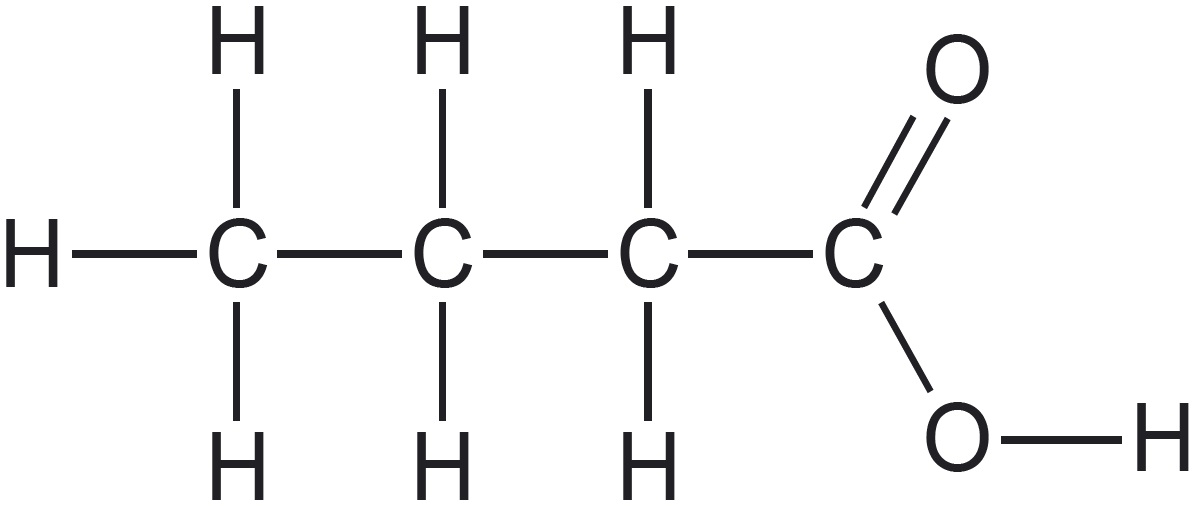 |
| lihtsustatud struktuurivalem | 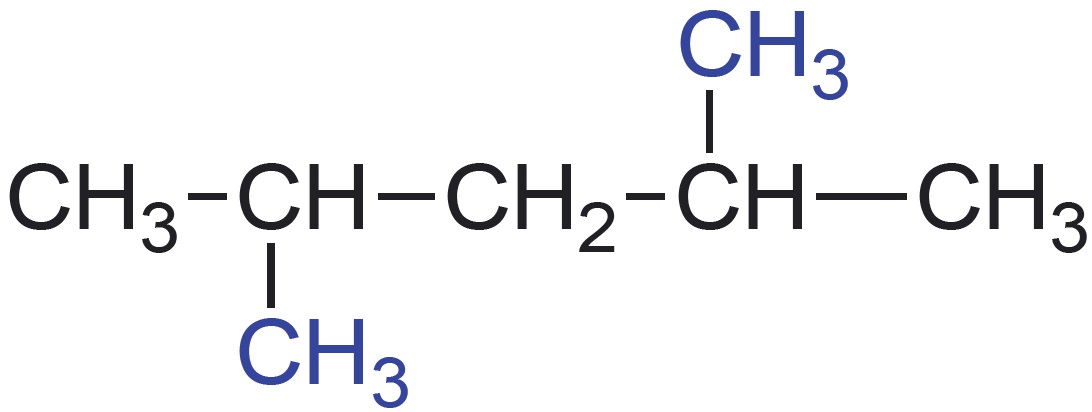 ehk $\ce{CH_3CH(}\textcolor{blue}{\ce{CH_3}}\ce{)CH_2CH(}\textcolor{blue}{\ce{CH_3}}\ce{)CH_3}$ Peaahelasse mittejäävad aatomirühmad kirjutatakse sulgudesse. | $\ce{CH_3-CH_2-CH_2-COOH}$ ehk $\ce{CH_3CH_2CH_2COOH}$ |
| graafiline kujutis | 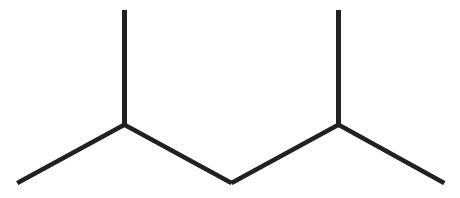 | 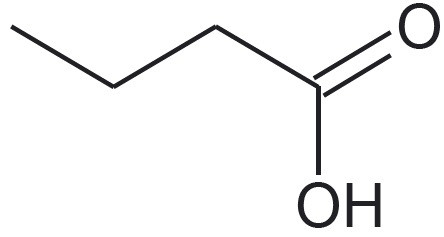 |
2,4-dimetüülpentaani summaarne valem on $\ce{C_7H_{16}}$ ning butaanhappel $\ce{C_4H_8O_2}$
Kuidas tõlgendada graafilise kujutise abil molekuli ehitust?
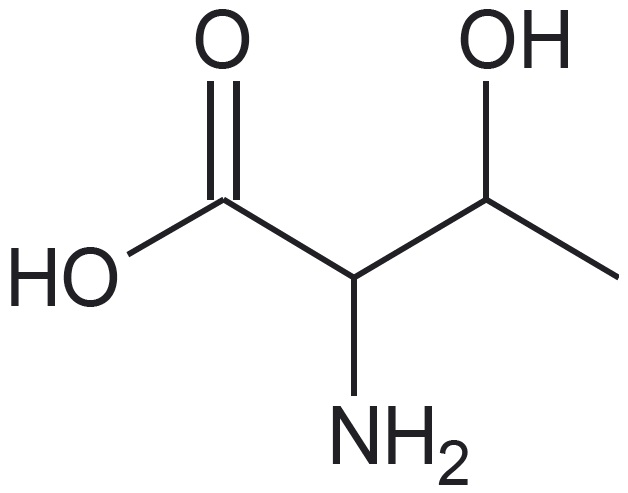
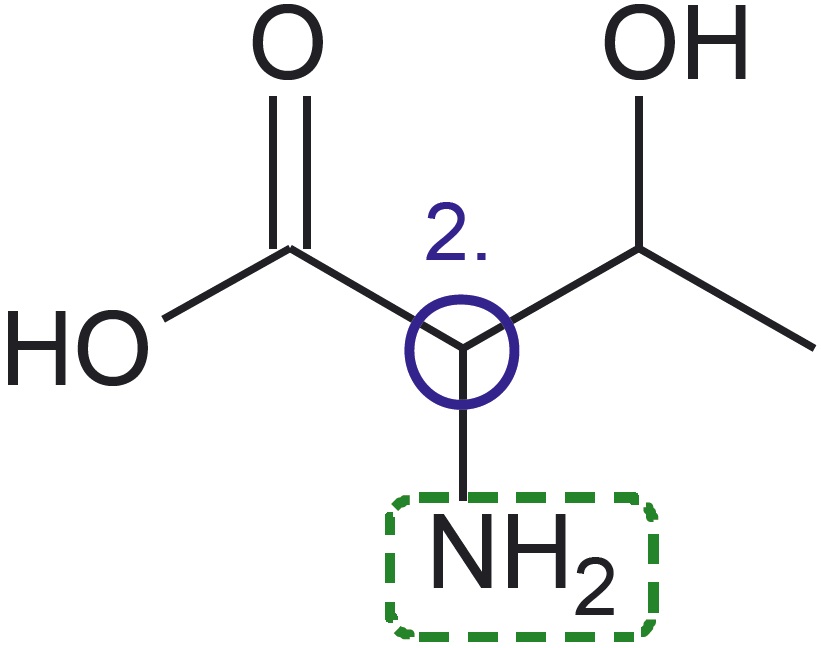
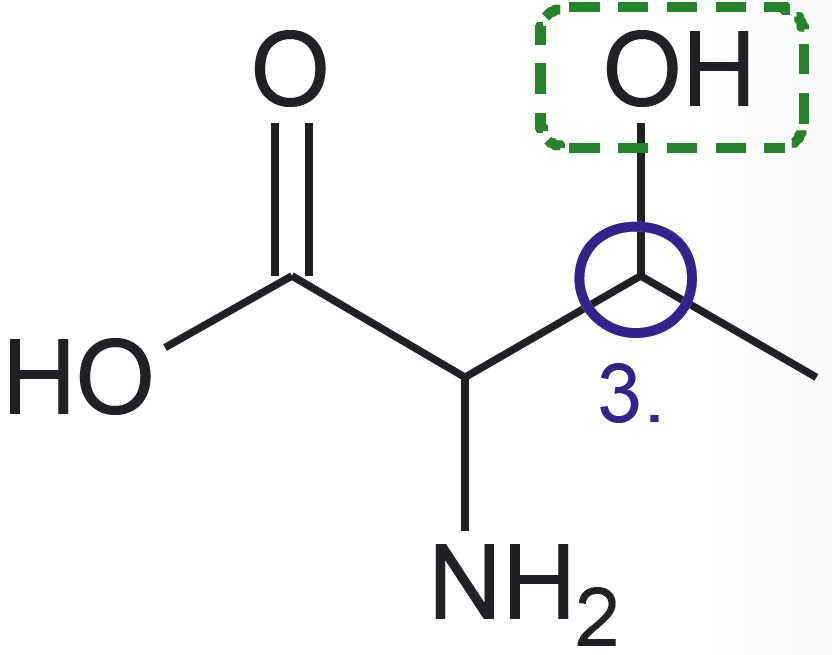
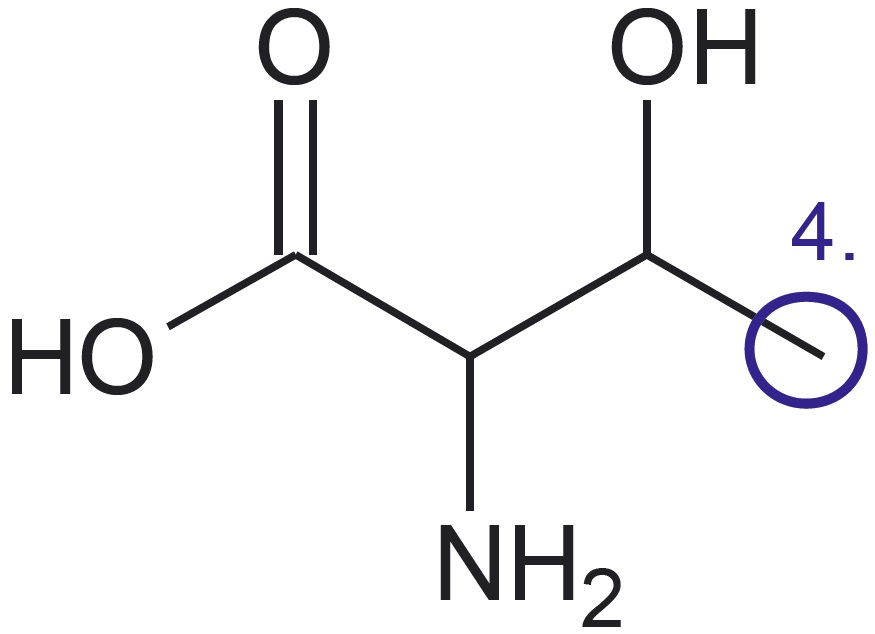
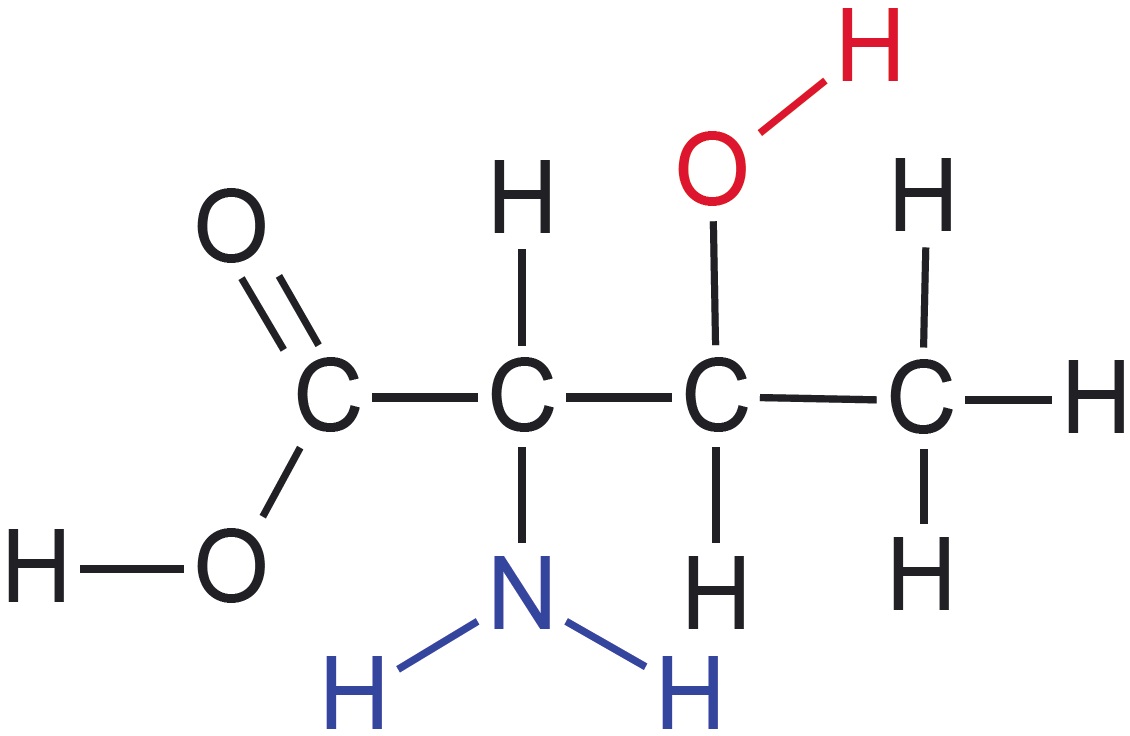
Esitatud on valkude koostises esineva aminohappe treoniini graafiline kujutise ja graafilise kujutise analüüsi valem:
Treoniini sisaldub märkimisväärselt nt läätsedes, samuti looma-, sea- ja linnulihas ning kalas.
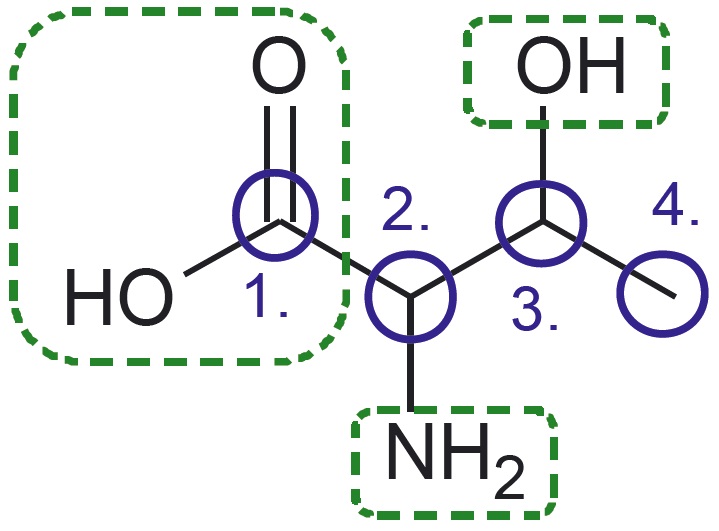
- Treoniini molekulis on neli süsiniku aatomit, mis on omavahel seotud üksiksidemete abil. Need on märgitud analüüsis siniste ringikestega ja tähistatud 1.–4.
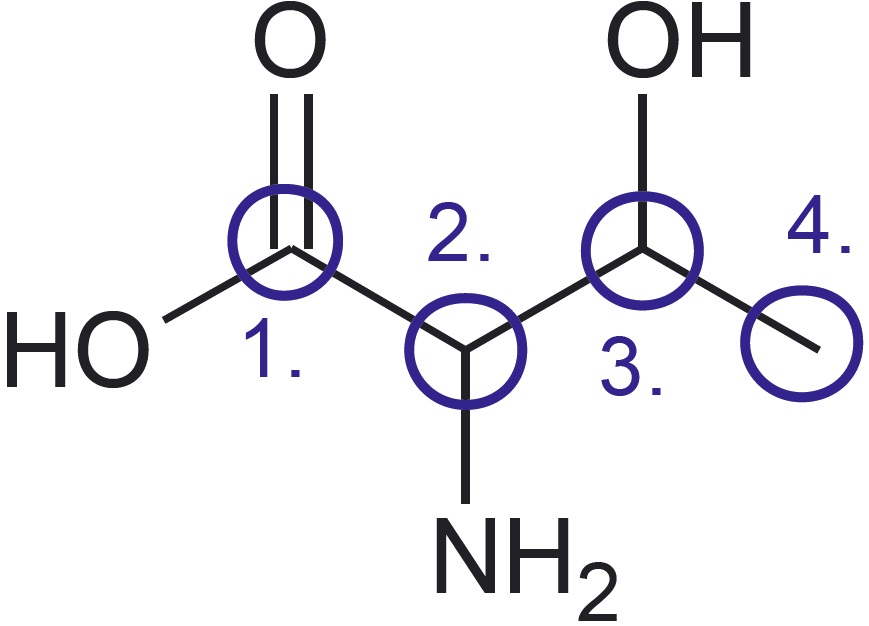
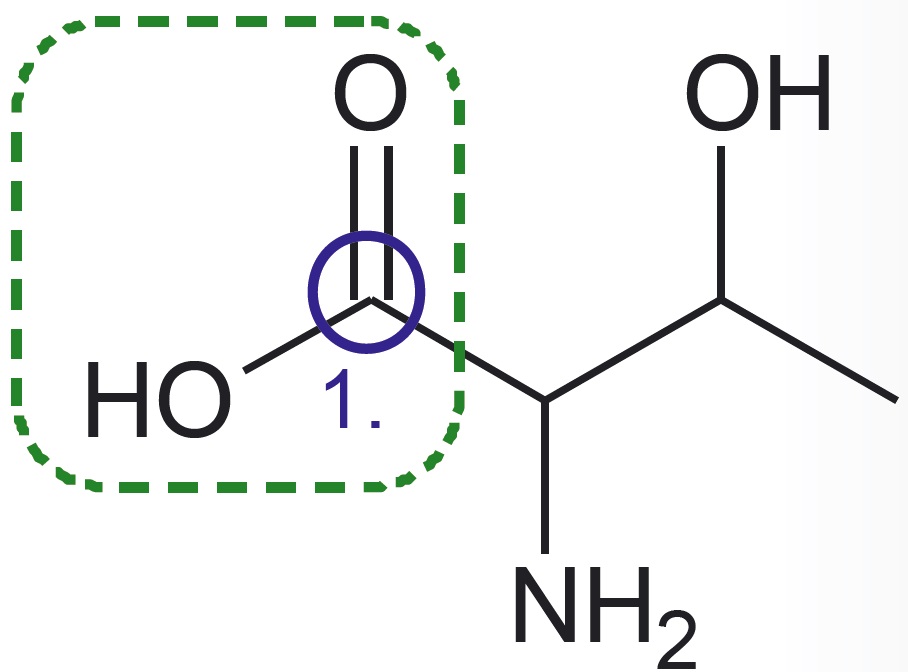
- Esimene süsiniku aatom on seotud kaksiksidemega hapniku aatomiga ning üksiksidemega hapniku aatomiga, mis omakorda on seotud vesiniku aatomiga. See rühm on põhikoolist tuttav karboksüülrühm.
- Teine süsiniku aatom on seotud üksiksidemega lämmastiku aatomiga, mis omakorda on seotud kahe vesiniku aatomiga. Seda rühma nimetatakse aminorühmaks.
- Kolmas süsiniku aatom on seotud hapniku aatomiga, mis omakorda on seotud ühe vesiniku aatomiga. See rühm on põhikoolist tuttav hüdroksüülrühm.
- Neljanda süsiniku aatomi juures pole midagi märgitud, järelikult on see seotud vaid vesiniku aatomitega. Ka teiste süsiniku aatomite puhul tuleb meeles pidada, et nendega seotud vesinike aatomeid pole märgitud. Nende arvu tuvastamine lähtub teadmisest, et süsinik moodustab neli sidet.
Eelneva analüüsi põhjal saame koostada treoniini tasapinnalise ja lihtsustatud struktuurivalemi.
$\ce{HOOC-CH(}\textcolor{blue}{\ce{NH_2}}\ce{)-CH(}\textcolor{red}{\ce{OH}}\ce{)-CH_3}$
Mis on erinevat tüüpi struktuurivalemite eelised ja puudused?
Tasapinnalise struktuurivalemi eeliseks on detailne molekuli ehituse kirjeldamine, ent selle koostamine on ajamahukas, võtab palju ruumi ega pruugi olla eriti ülevaatlik.
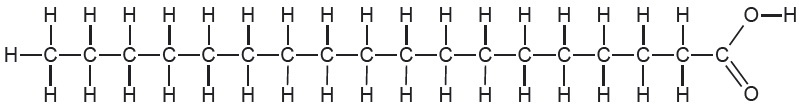
Lihtsustatud struktuurivalemi eelis võrreldes tasapinnalisega on aja- ja ruumisääst ning kindlasti ülevaatlikkus. Näiteks rasvhappe steariinhappe molekuli ehituse kirjeldamiseks on lihtsustatud struktuurivalem sobivam.
Steariinhape tasapinnaliselt:
Steariinhape lihtsustatult:
$\ce{CH_3CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2CH_2COOH}$
Veel mõistlikum on aga ühesugused struktuuriühikud (16 korda korduv $\ce{-CH_2-}$) “kokku kirjutada”: $\ce{CH_3(CH_2)_16COOH}$.
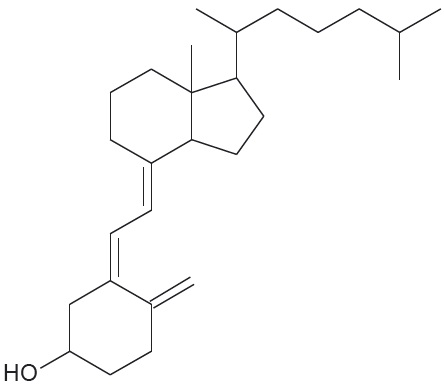
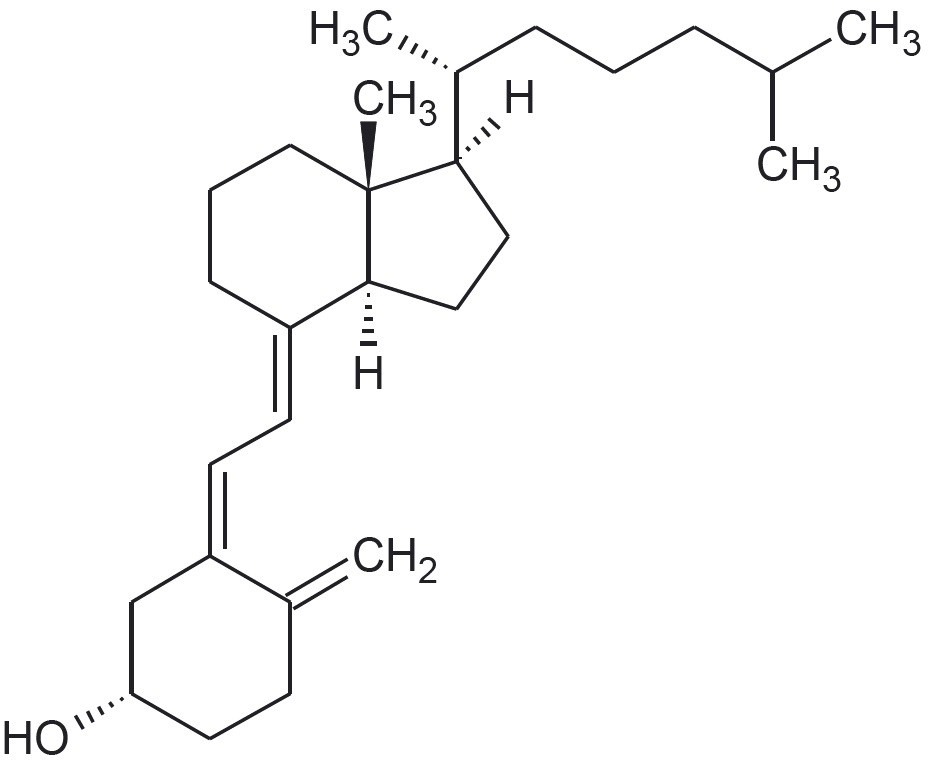
Graafilist kujutist võib pidada orgaanilises keemias „kiirkirjaks“ ning see sobib suurte ja keeruliste molekulide ehituse kirjeldamiseks, näiteks vitamiin D3 struktuuri on mõistlik näidata graafilise kujutise abil:
Graafiliselt on hõlbus kujutada ka mahukaid reaktsiooniskeeme. Esmase tutvuse tegemisel uute aineklassidega on aga mõistlik alustada lihtsamatest ühenditest ja tasapinnalistest struktuurivalemitest.
Kuidas märgitakse molekuli ruumilisust?
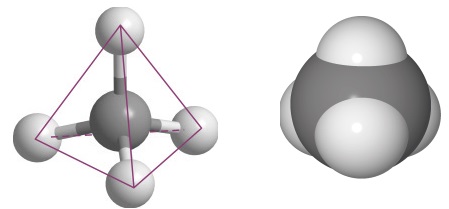
Orgaaniliste ühendite ehituses on oluline ka sidemete ruumiline paigutus (orienteeritus). Seetõttu näidatakse vajadusel, millised sidemed on suunatud tasapinna taha, millised ette. Kui süsiniku aatom on moodustanud neli üksiksidet, siis on need ruumiliselt suunatud tetraeedri tippudesse.
Molekulimudelina on seda võimalik kujutada nii:
Ruumilise struktuurivalemi abil kujutatakse seda järgmiselt:
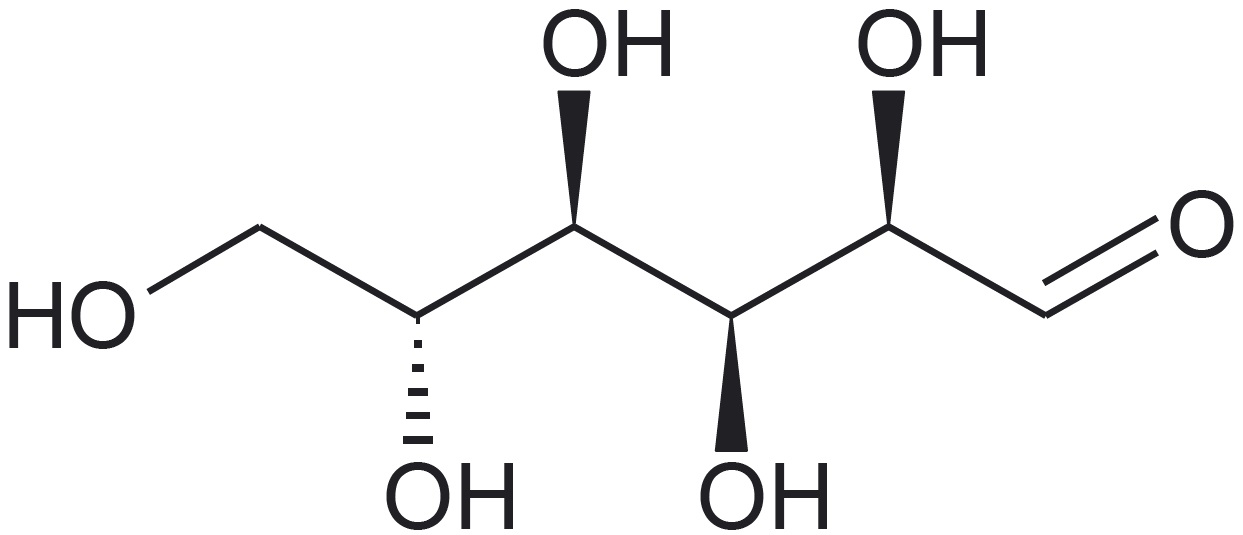
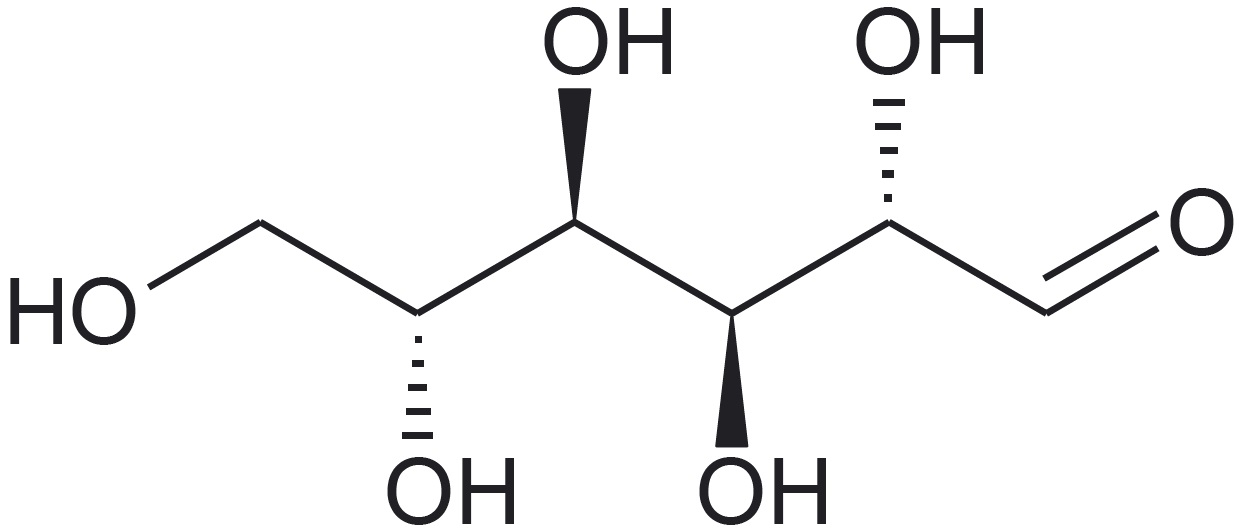
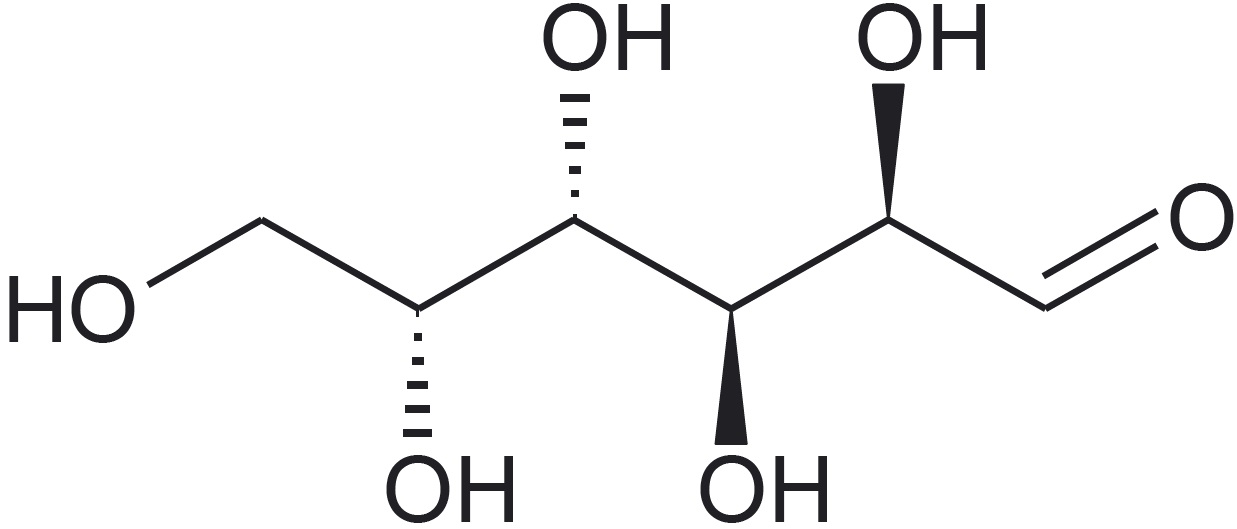
Aatomite ja aatomirühmituste ruumiline paigutus molekulides on väga oluline. Näiteks suhkrud glükoos, mannoos ja galaktoos erinevad üksteisest just aatomirühmituste ruumilise paigutuse poolest.*
Graafilises kujutises näidatakse mõnikord välja ka ahela otspunktides asuvad süsiniku aatomid koos vastavate vesiniku aatomitega. Vitamiin D3 graafiline kujutis, mis kajastab ka mitmete aatomite ja aatomirühmade ruumilist paigutust, näeb sel juhul välja järgmine:
* Selle kursuse raames molekulide ruumilisele ehitusele erilist tähelepanu ei pöörata – sellesse saate süveneda „Elu keemia“ valikkursuses.
Kokkuvõte
- Orgaaniline keemia on süsinikuühendite keemia. Orgaanilised ained sisaldavad (enamasti) $\ce{C-H}$ sidet.
- Süsiniku aatomid moodustavad orgaaniliste ainete molekulides neli kovalentset sidet. Süsiniku aatomid võivad moodustada nii üksik-, kaksik- kui ka kolmiksidemeid.
- Lisaks süsiniku aatomitele sisaldavad orgaanilised ained vesiniku aatomeid. Mitmetes orgaanilistes ühendites esinevad ka hapniku, lämmastiku, fosfori, väävli ja/või halogeenide aatomid.
- Tasapinnalises ehk klassikalises struktuurivalemis kirjutatakse välja kõik aatomid ja nendevahelised keemilised sidemed.
- Lihtsustatud struktuurivalemis kirjutatakse kokku iga süsiniku aatomi juurde kuuluvad aatomid või aatomite rühmad.
- Graafilises kujutises tähistab sirglõik kovalentset sidet ning süsiniku aatomid ja nende seotud vesiniku aatomid jäetakse märkimata: iga sirglõigu ots ja murdekoht märgib süsiniku aatomit koos juurde kuuluvate vesiniku aatomitega. Teiste elementide aatomid kirjutatakse koos nendega seotud vesiniku aatomitega välja.
Selle õppetüki läbimise järel:
- kasutate erinevaid molekuli kujutamise viise: lihtsustatud struktuurivalem, tasapinnaline ehk klassikaline struktuurivalem, molekuli graafiline kujutis.