1.2. METALLIDE REAGEERIMINE MITTEMETALLIDEGA
Enamik metalle võib sobivates tingimustes reageerida mittemetallidega. Need reaktsioonid kulgevad väga erineva kiirusega, olenevalt temperatuurist ja lähteainete aktiivsusest. Reaktsiooni saadusena tekivad vastavate metallide oksiidid, kloriidid, sulfiidid vm binaarsed ühendid.
Binaarsed ühendid
Binaarseteks ühenditeks nimetatakse ühendeid, mis koosnevad ainult kahe elemendi aatomitest.
Metallilise ja mittemetallilise elemendi binaarse ühendi nimetuses ja valemis märgitakse mittemetalliline, s.t elektronegatiivsem element alati viimasena ja selle elemendi nimetusele lisatakse lõpp -iid, nt kaltsiumoksiid $\ce{(CaO)}$, naatriumkloriid $\ce{(NaCl)}$, raud(II)sulfiid $\ce{(FeS)}$ jt.
Reegel, et binaarses ühendis märgitakse elektronegatiivsem element viimasena, kehtib üldreeglina ka mittemetalliliste elementide omavaheliste ühendite korral, nt lämmastikoksiid $\ce{(NO)}$, vesinikkloriid $\ce{(HCl)}$, süsinikdisulfiid $\ce{(CS_2)}$. Mittemetalliliste elementide binaarsete ühendite valemite kirjutamisel on siiski ka mõningaid ajalooliselt kujunenud erandeid, nt $\ce{NH_3}$ ja $\ce{CH_4}$ (ammoniaak ehk vesiniknitriid ja metaan ehk vesinikkarbiid).
METALLIDE AKTIIVSUSE VÕRDLUS REAGEERIMISEL MITTEMETALLIDEGA
Metall reageerib mittemetallidega seda aktiivsemalt, mida metallilisem ta on, s.t mida kergemini tema aatomid loovutavad oma väliskihi elektrone. Elemendi metallilisus on määratud tema aatomiehitusega ja järelikult selle elemendi asukohaga perioodilisustabelis. Elementide metallilisus suureneb perioodides paremalt vasakule ja A-rühmades ülevalt alla (siirdemetallide aktiivsus rühmas ülevalt alla üldreeglina väheneb).
Aktiivsed metallid (leelis- ja leelismuldmetallid)
Aktiivsete metallide ja aktiivsete mittemetallide (kloori, hapniku jt) vahelised reaktsioonid toimuvad üsna energiliselt juba tavatingimustes, eriti aktiivselt aga kuumutamisel.
$\ce{2Na(t) + Cl_2(g) -> 2NaCl(t)}$
Ka magneesium, mis jääb aktiivsete ja vähemaktiivsete metallide piirile, reageerib kuumutamisel väga aktiivselt mittemetallidega, nt hapnikuga. Kuna magneesium põleb silmipimestavalt valge leegiga, on seda reaktsiooni kasutatud valgustamiseks fotografeerimisel.
$\ce{2Mg(t) + O_2(g) -> 2MgO(t)}$
Vähemaktiivsed metallid
Suurem osa metalle, sh ka praktikas enamkasutatavad metallid raud, alumiinium, tina, plii, tsink, kroom, vask jpt, kuuluvad nn vähemaktiivsete metallide hulka.
Vähemaktiivsed metallid on mittemetallide suhtes küllaltki vastupidavad. Tavatingimustes nad mittemetallidega enamasti praktiliselt ei reageerigi või toimub see reaktsioon väga aeglaselt. Kuumutamisel võib reaktsioon aga olenevalt lähteainete aktiivsusest kulgeda üsna aktiivselt. Näiteks alumiiniumi ja väävli vaheline reaktsioon kulgeb kuumutamisel väga aktiivselt (reaktsioon on eksotermiline).
$\ce{2Al(t) + 3S(t) ->[t°] Al_2S_3(t), \Delta} H <0$
Paljud metallid, eriti siirdemetallid, saavad moodustada ühendeid erinevates oksüdatsiooniastmetes. Metalli reageerimisel mittemetalliga tekib enamasti ühend, milles metall on oma kõige püsivamas oksüdatsiooniastmes. Tuntumate metallide püsivaimad oksüdatsiooniastmed ühendites on toodud siin.
Raua oksüdatsiooniastmed ühendites mittemetallidega
Raud võib moodustada mittemetallidega ühendeid nii oksüdatsiooniastmes III kui ka II, olenevalt mittemetalli aktiivsusest. Raua reageerimisel klooriga tekib raud(III)kloriid, sest kloor on väga tugev oksüdeerija.
$\ce{2Fe(t) + 3Cl_2(g) ->[t°] 2FeCl_3(t)}$
Raua reageerimisel väävliga tekib aga raud(II)sulfiid, sest väävel on palju vähem aktiivne (s.t palju nõrgem oksüdeerija) kui kloor.
$\ce{Fe(t) + S(t) ->[t°] FeS(t)}$
Väga vähe aktiivsed metallid ehk väärismetallid
Väärismetallid on oksüdeerumise suhtes eriti vastupidavad, seepärast nimetataksegi neid väärismetallideks. Ka kuumutamisel nad enamiku mittemetallidega, sh hapnikuga ei reageeri.
Igapäevaelus tuntumad väärismetallid on kuld, plaatina ja hõbe, keemiliselt püsivaim nendest on kuld.
METALLIDE REAGEERIMINE HAPNIKUGA
Hapnik on tavatingimustes kõige levinum ja tugevam oksüdeerija. Seetõttu on väga oluline tunda praktikas kasutatavate metallide vastupidavust hapniku suhtes. Õhuhapniku toimel moodustub enamiku vähemaktiivsete metallide $\ce{(Al, Zn, Cr, Mn}$ jpt $\ce{)}$ pinnale õhuke tihe oksiidikiht, mis takistab metalli edasist oksüdeerumist.
Oksiidikihi tõttu võib metall kaotada läike ja muutuda tuhmiks.
Kõrgematel temperatuuridel oksiidikiht metalle enam ei kaitse ja reaktsioon võib kulgeda küllaltki aktiivselt. Tavatingimustes hapniku suhtes hästi vastupidav alumiinium reageerib kuumutamisel aktiivselt hapnikuga, eraldades palju soojust.
$\ce{4Al(t) + 3O_2(g) ->[t°] 2Al_2O_3(t), \Delta} << 0$
Paljude suhteliselt aktiivsemate metallide $\ce{(Fe, Cr}$ jt $\ce{)}$ värskeltvalmistatud peeneteraline pulber, mis pole jõudnud veel pinnalt oksüdeeruda, on palju aktiivsem kui oksiidikihiga kattunud metall. Seetõttu tuleb metallide mehaanilisel töötlemisel olla ettevaatlik, sest tekkiv metallipuru võib õhus kergesti süttida.
| A-rühmade metallide püsivamaid oksiide* | |||||
| IA | IIA | IIIA | IVA | VA | |
| 2. periood | $\ce{Li_2O}$ | $\ce{BeO}$ | |||
| 3. periood | $\textcolor{green}{\ce{Na_2O_2}}$ | $\ce{MgO}$ | $\ce{Al_2O_3}$ | ||
| 4. periood | $\textcolor{blue}{\ce{KO_2}}$ | $\ce{BeO}$ | $\ce{Ga_2O_3}$ | $\ce{GeO_2}$ | |
| 5. periood | $\ce{BeO}$ | $\ce{SrO}$ | $\ce{Ln_2O_3}$ | $\ce{SnO_2}$ | $\ce{Sb_2O_3}$ $\ce{Sb_2O_5}$ |
| 6. periood | $\textcolor{blue}{\ce{CsO_2}}$ | $\textcolor{green}{\ce{BaO_2}}$ | $\ce{Tl_2O}$ | $\ce{PbO}$ $\ce{Pb_3O_4}$ | $\ce{Bi_2O_3}$ |
| * Enamikule leelismetallidele ja mõnele leelismuldmetallile pole iseloomulikud mitte oksiidid, vaid peroksiidid (tähistatud $\textcolor{green}{\textnormal{rohelise värvusega}}$) või hüperoksiidid (tähistatud $\textcolor{blue}{\textnormal{sinise värvusega}}$). | |||||
| 4. perioodi siirdemetallide püsivamaid oksiide | |||||||||
| IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | ||
| $\ce{Sc_2O_3}$ | $\ce{TiO_2}$ | $\ce{V_2O_5}$ | $\ce{Cr_2O_3}$ | $\ce{MnO_2}$ | $\ce{Fe_2O_3}$ $\ce{Fe_3O_4}$ | $\ce{CoO}$ $\ce{Co_2O_3}$ | $\ce{NiO}$ | $\ce{Cu_2O}$ $\ce{CuO}$ | $\ce{ZnO}$ |
Raua reageerimisel hapnikuga võivad olenevalt tingimustest tekkida erinevad saadused. Niiskes õhus seismisel tekib raua pinnale poorne roostekiht (selle põhikoostisaine on raud(III)oksiid $\ce{Fe_2O_3}$), mis ei takista hapniku ligipääsu metallile.
Raua roostetamist vaatleme lähemalt ptk 2.3.
Õhus kuumutamisel moodustub raua pinnale aga nn rauatagi koostisega $\ce{Fe_3O_4}$ (seda ühendit võib vaadelda kui raud(II)- ja raud(III)-segaoksiidi $\ce{FeO * Fe_2O_3}$).
$\ce{3Fe(t) + 2O_2(g) -> Fe_3O_4(t)}$
Rauatagi kiht on üsna õhuke ja tihe. Seetõttu muutub raud pärast kuumutamist roostetamise suhtes palju vastupidavamaks.
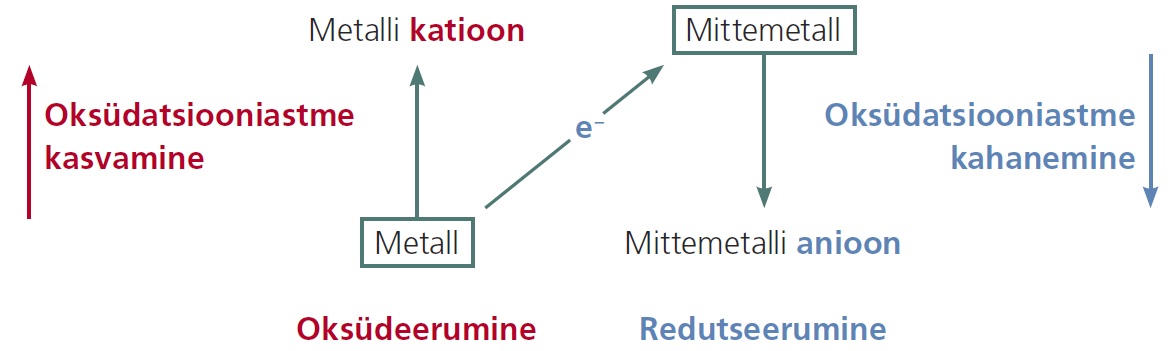
METALLI REAGEERIMINE MITTEMETALLIGA KUI REDOKSREAKTSIOON
Keemilistes reaktsioonides metallid alati loovutavad elektrone, s.t käituvad redutseerijana.
Oksüdeerijana võivad metallide suhtes käituda paljud ained, sealhulgas ka mittemetallid.
Metalli reaktsioon mittemetalliga on redoksreaktsioon, milles metall käitub redutseerijana.
Metalli aatomid loovutavad elektrone, muutudes metalli katioonideks. Metallilise elemendi oksüdatsiooniaste seega kasvab.
Mittemetalli aatomid liidavad elektrone, muutudes vastavateks anioonideks. Mittemetallilise elemendi oksüdatsiooniaste seega kahaneb.
Magneesiumi reageerimine hapnikuga
Magneesiumi aatom loovutab 2 elektroni, moodustades $\ce{Mg^{2+}}$-iooni (magneesiumi oksüdatsiooniaste kasvab).
$\ce{Mg – 2e^- -> Mg^{2+}}$
Hapniku aatom liidab $2$ elektroni, moodustades $\ce{O_2^-}$-iooni (hapniku oksüdatsiooniaste kahaneb).
$\ce{O + 2e^- -> O^{2-}}$
Lihtainena ei koosne hapnik mitte üksikaatomitest, vaid $\ce{O_2}$ molekulidest. Hapniku molekul liidab $4$ elektroni ja temast tekib $2$ oksiidiooni.
$\ce{O_2 + 4e^- -> 2O_2^{2-}}$
Kogu reaktsioonivõrrand tasakaalustatud kujul on järgmine:
$\underset{\textnormal{redutseerija}}{\ce{2} \textcolor{blue}{\ce{Mg}}} \overset{\ce{->[4e^-]}}{\ce{+}} \underset{\textnormal{oksüdeerija}}{\textcolor{red}{\ce{O_2}}} \ce{-> 2MgO}$
Kaks $\ce{Mg}$ aatomit loovutavad reaktsioonis kokku $4$ elektroni ja üks hapniku molekul liidab samuti $4$ elektroni. Redoksreaktsioonides on loovutatud elektronide arv alati võrdne liidetud elektronide arvuga.
Redoksreaktsioonide tasakaalustamise põhimõtteid käsitletakse põhjalikumalt õpiku lisas (ptk 5.1).
KOKKUVÕTE
- Metalli aktiivsus reageerimisel mittemetallidega on määratud sellega, kui kergesti metalli aatomid loovutavad elektrone.
- Kõige energilisemalt reageerivad mittemetallidega aktiivsed metallid (leelis- ja leelismuldmetallid).
- Vähemaktiivsed metallid on tavatingimustes mittemetallide suhtes küllaltki vastupidavad. Nende metallide pinnale tekib õhus seismisel õhuke oksiidikiht, mis enamasti kaitseb metalli edasise korrosiooni eest.
- Metalli ja mittemetalli vaheline reaktsioon on redoksreaktsioon, milles metall käitub redutseerijana, mittemetall oksüdeerijana.
KÜSIMUSED
- Kuidas on metalli aktiivsus reageerimisel mittemetallidega seotud metalli asukohaga perioodilisustabelis?
- Tooge näiteid aktiivsetest, vähemaktiivsetest ja väga vähe aktiivsetest metallidest (väärismetallidest). Võrrelge nende aktiivsust reageerimisel mittemetallidega, nt hapnikuga.
- Selgitage redoksreaktsioonide toimumise põhimõtet metallide ja mittemetallide vaheliste reaktsioonide näitel.
- Kirjutage (ja tasakaalustage) järgmiste reaktsioonide võrrandid.
- $\ce{Na + S ->}$
- $\ce{Ca + Cl_2 ->}$
- $\ce{Al + O_2 ->[t°]}$
- $\ce{Cu + O_2 ->[t°]}$
- $\ce{Fe + O_2 ->[t°]}$