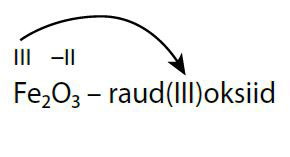1. Oksiidid. Happelised ja aluselised oksiidid
MIKS ÕPPIDA TUNDMA HAPPELISI JA ALUSELISI OKSIIDE?
Tähtsamate oksiidide ja nende rakendustega tutvusid põgusalt juba 8. klassis. Meenutame, et oksiidid on ained, mis koosnevad kahest keemilisest elemendist, millest üks on hapnik. Oksiididel on küll sarnane koostis, kuid nende keemilised omadused võivad olla väga erinevad. Oksiide liigitatakse keemiliste omaduste alusel happelisteks ja aluselisteks oksiidideks. Juba inglise keemik Joseph Priestley pani tähele, et süsinikdioksiidi juhtimisel vette moodustus meeldiv kergelt hapuka maitsega lahus. Selles õppetükis tutvudki, kuidas nii happelised kui ka aluselised oksiidid reageerivad veega.
Tegelikult on oksiide nelja liiki: lisaks nimetatutele veel amfoteersed ja neutraalsed oksiidid.¹
¹ Kaldkirjaga eristatud kommentaarid on mõeldud silmaringi laiendamiseks ja õpitava sügavamaks mõistmiseks, mitte aga äraõppimiseks.
MIDA ÕPPISID OKSIIDIDE KOHTA 8. KLASSIS?
Oksiidide nimetuse üldkuju on:
elemendi nimi + (o.a) + oksiid.
Kui metallilise elemendi o.a ühendis on kindel (IA, IIA, IIIA), siis seda nimetusse ei lisata. Mittemetallioksiidide nimetustes eelistatakse tähistada elementide aatomite arve kreekakeelsete eesliidetega:
2 – di-, 3 – tri-, 4 – tetra-, 5 – penta-, 6 – heksa-, 7 – hepta-, 8 – okta-, 9 – nona-, 10 – deka-
Näited:
Oksiidid tekivad liht- ja liitainete reageerimisel hapnikuga. Reaktsioonivõrrandite koostamisel pea silmas, et hapniku molekuli valem on \(\displaystyle {{\text{O}}_{2}}\). Oksiidi valemi koostamisel kasutatakse oksüdatsiooniastmeid. Reaktsioonivõrrand tuleb tasakaalustada.
\[\text{4Li + }{{\text{O}}_{\text{2}}}\to \text{2}{{\overset{\text{I}}{\mathop{{\text{Li}}}}\,}_{\text{2}}}\overset{{\text{$-$II}}}{\mathop{\text{O}}}\,\]
MIS ON HAPPELINE OKSIID?
Happelised oksiidid on hapetele vastavad oksiidid.
Tuntumad happelised oksiidid on mittemetallioksiidid.
Tabelisse on koondatud olulisemad happed ja nendele vastavad oksiidid. Ainult nendel hapetel, mis sisaldavad hapnikku, on vastav happeline oksiid. Happes ja vastavas happelises oksiidis on mittemetallilisel elemendil sama o.a.
| Hape | Vastav happeline oksiid |
|---|---|
| \(\displaystyle {{\text{H}}_{\text{2}}}\overset{{\text{VI}}}{\mathop{\text{S}}}{{\text{O}}_{\text{4}}}\) – väävelhape | \(\displaystyle \overset{{\text{VI}}}{\mathop{\text{S}}}{{\text{O}}_{\text{3}}}\) – vääveltrioksiid |
| \(\displaystyle {{\text{H}}_{\text{2}}}\overset{{\text{IV}}}{\mathop{\text{S}}}{{\text{O}}_{\text{3}}}\) – väävlishape | \(\displaystyle \overset{{\text{IV}}}{\mathop{\text{S}}}{{\text{O}}_{\text{2}}}\) – vääveldioksiid |
| \(\displaystyle {{\text{H}}_{\text{2}}}\overset{{\text{IV}}}{\mathop{\text{C}}}{{\text{O}}_{\text{3}}}\) – süsihape | \(\displaystyle \overset{{\text{IV}}}{\mathop{\text{C}}}{{\text{O}}_{\text{2}}}\) – süsinikdioksiid |
| \(\displaystyle {{\text{H}}_{\text{3}}}\overset{{\text{V}}}{\mathop{\text{P}}}{{\text{O}}_{\text{4}}}\) – fosforhape | \(\displaystyle {{\overset{\text{V}}{\mathop{\text{P}}}}_{\text{4}}}{{\text{O}}_{{\text{10}}}}\) – tetrafosfordekaoksiid |
| \(\displaystyle {{\text{H}}_{\text{2}}}\overset{{\text{VI}}}{\mathop{{\text{Si}}}}{{\text{O}}_{3}}\) – ränihape | \(\displaystyle \overset{{\text{IV}}}{\mathop{\text{Si}}}{{\text{O}}_{\text{2}}}\) – ränidioksiid |
| \(\displaystyle \text{H}\overset{\text{V}}{\mathop{\text{N}}}{{\text{O}}_{\text{3}}}\) – lämmastikhape | \(\displaystyle \overset{\text{V}}{\mathop{{{{\text{N}}_{2}}}}}{{\text{O}}_{5}}\) – dilämmastikpentaoksiid |
Kõik mittemetallioksiidid ei ole happeliste omadustega. Näiteks \(\displaystyle \text{CO}\), \(\displaystyle \text{NO}\) ning \(\displaystyle {{\text{N}}_{\text{2}}}\text{O}\) on neutraalsed oksiidid (neil puuduvad nii happelised kui ka aluselised omadused).
MIS MOODUSTUB HAPPELISE OKSIIDI REAGEERIMISEL VEEGA?
Enamik happelisi oksiide reageerib veega. See on ühinemisreaktsioon, mille käigus moodustub oksiidile vastav hape.
\(\displaystyle \textbf{happeline oksiid + }{{\textbf{H}}_{2}}\textbf{O}\to \textbf{hape}\)
Tuntumatest happelistest oksiididest ei reageeri veega ränidioksiid \(\displaystyle \text{Si}{{\text{O}}_{2}}\) , mis on ühtlasi liiva põhikomponent.
\(\displaystyle \text{Si}{{\text{O}}_{2}}\text{ + }{{\text{H}}_{\text{2}}}\text{O }\to \text{ ei kulge}\)
Paljud hapnikhapped lagunevad kuumutamisel vastavaks oksiidiks ja veeks, nt ränihape:\(\displaystyle {{\text{H}}_{\text{2}}}\text{Si}{{\text{O}}_{\text{3}}}\text{ }\to \text{ }{{\text{H}}_{\text{2}}}\text{O + Si}{{\text{O}}_{\text{2}}}\)
KUS LEIAB ASET HAPPELISE OKSIIDI REAGEERIMINE VEEGA?
Argielus puutume kokku süsinikdioksiidi ja vee vahelise ühinemisreaktsiooniga. Süsinikdioksiidi lahustumisel vees reageerib osa sellest veega ning moodustub süsihape:
\(\displaystyle \text{C}{{\text{O}}_{2}}\text{ + }{{\text{H}}_{2}}\text{O }\to {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}\)
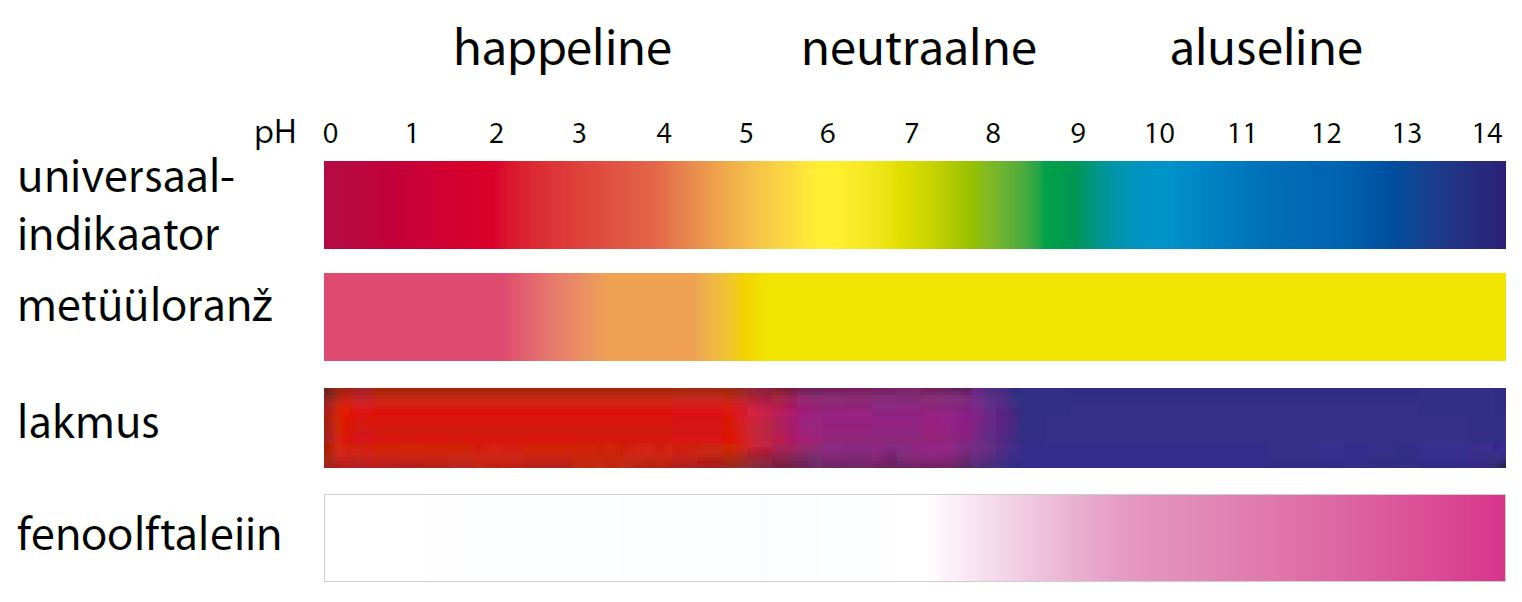
See reaktsioon kulgeb nii jookide gaseerimisel kui ka atmosfääris oleva süsihappegaasi lahustumisel vihmavees. Seetõttu on ka puhas vihmavesi alati kergelt happeline (pH ≈ 5,6).


Atmosfääris reageerivad veega ka mitmed teised gaasilised mittemetallioksiidid. Tuntum neist on vääveldioksiid, mille lahustumisel vees kulgeb keemiline reaktsioon, mille käigus moodustub väävlishape.
\(\displaystyle \text{S}{{\text{O}}_{2}}\text{ + }{{\text{H}}_{\text{2}}}\text{O}\to {{\text{H}}_{2}}\text{S}{{\text{O}}_{3}}\)
See reaktsioon põhjustab happesademeid, millega tutvume lähemalt 9. õppetükis.
KUIDAS KASUTATAKSE HAPPELISE OKSIIDI REAGEERIMIST VEEGA?
Happelise oksiidi reageerimist veega kasutatakse keemiatööstuses hapete valmistamiseks. Väävelhappe tööstusliku saamise viimases etapis kulgeb vääveltrioksiidi reageerimine veega:
\(\displaystyle \text{S}{{\text{O}}_{3}}\text{+ }{{\text{H}}_{\text{2}}}\text{O}\to {{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}\)
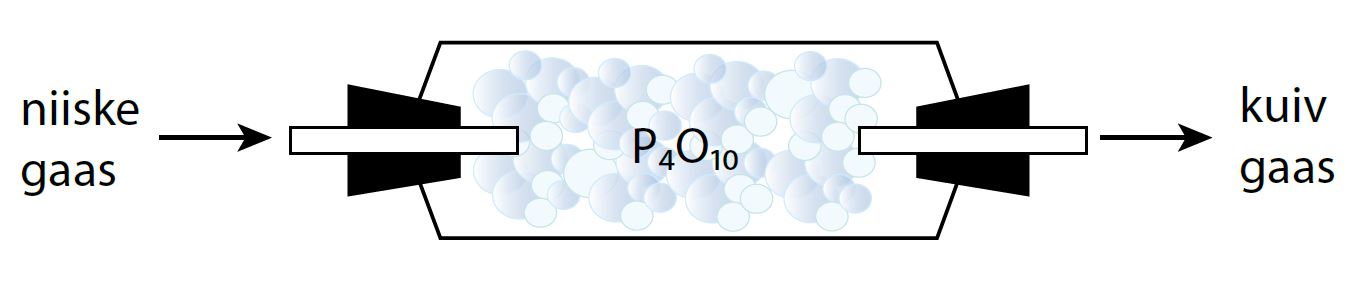
Laboratoorselt kasutatakse tahke tetrafosfordekaoksiidi \(\displaystyle {{\text{P}}_{4}}{{\text{O}}_{{10}}}\) reageerimist veega ainete kuivatamiseks: \(\displaystyle {{\text{P}}_{4}}{{\text{O}}_{{10}}}\) seob ainetest niiskust, muundudes selle käigus fosforhappeks.
\[\displaystyle {{\text{P}}_{4}}{{\text{O}}_{{10}}}\text{+ 6}{{\text{H}}_{2}}\text{O}\to \text{4}{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}\]
MIS ON ALUSELINE OKSIID?
Aluselised oksiidid on alustele vastavad oksiidid.
Metallioksiidid on tavaliselt aluselised oksiidid.
Aluses ja aluselises oksiidis on metallilise elemendi o.a sama. Näiteks on naatriumhüdroksiidile \(\displaystyle \overset{\text{I}}{\mathop{{\text{Na}}}}\,\text{OH}\) vastav oksiid naatriumoksiid \(\displaystyle {{\overset{\text{I}}{\mathop{{\text{Na}}}}\,}_{2}}\text{O}\).
Mõningatele metallioksiididele on iseloomulikud ka happelised omadused (nt \(\displaystyle \text{Cr}{{\text{O}}_{3}}\), \(\displaystyle \text{M}{{\text{n}}_{2}}{{\text{O}}_{7}}\)). Mõned metallioksiidid on amfoteersed, s.t samaaegselt happeliste ja aluseliste omadustega (nt \(\displaystyle \text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}\), \(\displaystyle \text{ZnO}\), \(\displaystyle \text{C}{{\text{r}}_{2}}{{\text{O}}_{3}}\)).
MIS MOODUSTUB ALUSELISE OKSIIDI REAGEERIMISEL VEEGA?
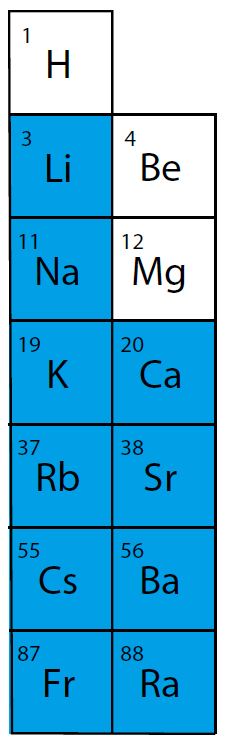
Veega reageerivad leelistele vastavad ehk tugevalt aluselised oksiidid. Need on IA rühma ja IIA rühma (alates kaltsiumist) metalliliste elementide oksiidid. Nende reageerimisel veega kulgeb ühinemisreaktsioon ning moodustub vastav alus (hüdroksiid).
\(\displaystyle \underset{{\text{(IA ja IIA alates Ca metallioksiid)}}}{\mathop{{\text{aluseline oksiid}}}}\,\text{ + }{{\text{H}}_{2}}\text{O }\to \text{tugev alus ehk leelis}\)
Kaltsiumoksiidi reageerimisel veega moodustub kaltsiumhüdroksiid:
\(\displaystyle \text{CaO + }{{\text{H}}_{2}}\text{O }\to \text{ Ca(OH}{{\text{)}}_{2}}\)
Seda reaktsiooni nimetatakse lubja kustutamiseks. Meenutame, et \(\displaystyle \text{CaO}\) rahvapärane nimetus on kustutamata lubi ning lubimördi valmistamiseks kasutatava \(\displaystyle \text{Ca(OH}{{\text{)}}_{2}}\) rahvapärane nimetus on kustutatud lubi.

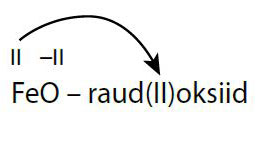
Nõrgalt aluselised oksiidid veega ei reageeri.
Näiteks: \(\displaystyle \text{Fe}{{\text{O}}}\text{ + }{{\text{H}}_{\text{2}}}\text{O }\to \text{ ei kulge}\)
Hüdroksiidid (v.a IA rühma metallide omad) lagunevad kuumutamisel vastavaks oksiidiks ja veeks: \(\displaystyle \text{Fe(OH}{{\text{)}}_{2}}\to \text{FeO + }{{\text{H}}_{2}}\text{O}\)
Kokkuvõte
- Happelised oksiidid on hapetele vastavad oksiidid. Tuntumad happelised oksiidid on mittemetallioksiidid.
- Aluselised oksiidid on alustele vastavad oksiidid. Metallioksiidid on tavaliselt aluselised oksiidid.
- Happelise oksiidi reageerimisel veega tekib hape: \(\text{happeline oksiid (mittemetallioksiid) + }{{\text{H}}_{2}}\text{O}\to \text{hape (v}\text{.a Si}{{\text{O}}_{2}}\text{) }\)
- Aluselise oksiidi reageerimisel veega tekib alus: \(\text{aluseline oksiid (IA ja IIA alates Ca metallioksiid) + }{{\text{H}}_{2}}\text{O }\to\)\(\text{tugev alus ehk leelis}\)
SELLE ÕPPETÜKI LÄBIMISE JÄREL PEAKSID
- oskama kasutada seoseid järgmiste aineklasside vahel, koostada vastavate reaktsioonide võrrandeid ja korraldada neid reaktsioone ohutult:
- happeline oksiid + vesi,
- (tugevalt) aluseline oksiid + vesi.