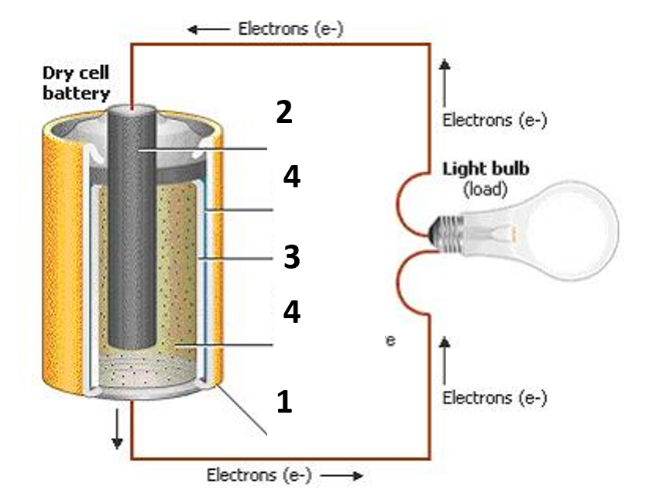
Keemiline vooluallikas – galvaanielement
Kõige lihtsam keemiline vooluallikas – galvaanielement koosneb järgmistest osadest:
(1) ümbritsev, enamasti tsingist kest, mis on tavaliselt ka vooluallika negatiivseks pooluseks
(2) vaskelektrood, mis on vooluallika positiivseks pooluseks
(3) poorne vahesein, mis laseb endast läbi ioone ja elektrone, aga mitte lahuseid
Sulle võivad huvi pakkuda need õppematerjalid:
Liitmine ja lahutamine 20 piires
MEISTERDA! Liikuv kaart sõbrapäevaks
Kirjeldav statistika
Segame värve!
MEISTERDA! Jõulupuu laua kaunistamiseks
Harjutusülesandeid matemaatika riigieksamiks
Protsendi rakendused igapäevaelus
Üksliikmed, hulkliikmed ja tehted nendega
Õpime tähti. Ü-täht
Eesti keele grammatika gümnaasiumile: algustäheortograafia
Põhiseadus selgeks! Kordamine põhikooli ühiskonnaõpetuse lõpueksamiks
Eesti keele grammatika gümnaasiumile: numbrite kirjutamine
Protsendid põhikooli matemaatikas
Õpi eesti keelt teise keelena B2. Kuulamine
(4) elektrolüüt – enamasti on teine teisel pool vaheseina erineva soola vesilahus.
Elektrolüüdis asuvad metallid hakkavad elektrolüüdis lahustuma. Tulemuseks on vabade elektronide positiivsete tsingiioonide tekkimine lahuses. Siin tuleb märkida, et lahusesse lisandub tsinkelektroodilt ainult tsingiioone, vaseioonid on vastavas lahuses juba iseenesest olemas, neid vaskelektroodilt juurde ei teki. Vaskelektroodil toimub hoopis vaseioonide välja sadestumine – ioon liidab endaga vajalikul arvul elektrone, muundub aatomiks ning sadestub.
Tänu ühel pool vaheseina toimuvale ioonide lisandumisele ja teisel pool seina toimuvale sadestumisele, tekibki elektroodide laengute erinevus – tsinkelektroodist saab vooluallika negatiivne poolus, vaskelektroodist aga positiivne.
Keemiliste reaktsioonide tulemusena tekib elemendis (sise)energia ülejääk, mis muundubki elektrienergiaks.
Taoline protsess saab kesta seni, kuni soolalahusel on piisavalt võimekust uusi tsinkioone tekitada. Kui võimekus kaob, lakkab galvaanielement töötamast ning tema võimet laenguid eraldada pole võimalik taastada – seepärast öeldakse, et galvaanielemendis toimuvad protsessid on mittepööratavad.
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!