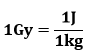Radioaktiivsus
Radioaktiivsuse kui nähtuse avastas 1896. aastal Prantsusmaa füüsik Henri Becquerel, kes uuris uraanisoolade iseeneslikku helendamist (luminestsentsi) ning avastas, et
- uraanisoolad kiirgavad iseeneslikku so ilma igasuguse välismõjutuseta kiirgust;
- selle kiirguse intensiivsus ei sõltu aine mõjutamisest (kuumutamisest, valgustamisest, keemilistest protsessidest vms);
- tekkiv kiirgus on küllaltki suure läbitungimise võimega,
- tekkiv kiirgus ioniseerib aineid, mida ta läbib;
- kiirguse hulga määrab ainult uraani, mitte soola hulk preparaadis so see kiirgus on omane uraanile kui keemilisele elemendile.
Henri Becqereli poolt avastatud ainete võimet iseeneslikult kiirguda, nimetatakse radioaktiivsuseks. Suure panuse radioaktiivsuse uurimisse andsid Pierre ja Marie Curie, kes avastasid hulgaliselt radioaktiivseid keemilisi elemente (poloonium, raadium jpt) ning uurisid nende omadusi ja mõju elusrakkudele. Curie’d tegid kindlaks, et kõik keemilised elemendid, mille järjekorranumber on suurem kui 83 on radioaktiivsed. Radioaktiivseid isotoope omavad aga ka kõik keemilised elemendid.
Sulle võivad huvi pakkuda need õppematerjalid:
Liitmine ja lahutamine 20 piires
Õpime tähti. Ü-täht
Õpime tähti. K-täht
Aigar Vaigu ja Andres Juur. Õpioskuste omandamine ning reaal- ja loodusained
Õpi eesti keelt teise keelena B2. Kuulamine
Õpime tähti. I-täht
Harjutamine teeb meistriks: kuhu käib koma?
Õpi eesti keelt teise keelena B2. Grammatika
INETU PARDIPOEG. Muinasjutt kuulamiseks
Oksüdatsiooniaste
Õpime tähti. L-täht
Harjutusülesandeid matemaatika riigieksamiks
MEISTERDA! Papist kevadlill
Ioniseerivad kiirgused ja nende toimed
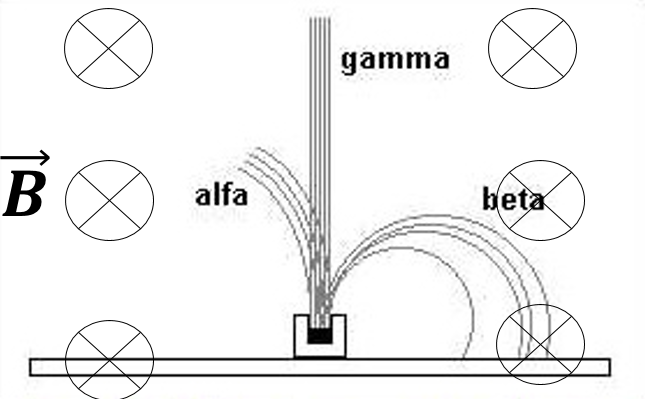
Ernest Rutherford avastas, et radioaktiivset kiirgust on magnetväljas võimalik lahutada komponentideks:
- kõige väiksema läbitungimise võimega kiirgus (teda peatab juba paberleht) hakati nimetama α-kiirguseks. Ta käitub magnetväljas nagu positiivselt laetud osakeste voog. Tehti kindlaks, et α-kiirgus koosneb heelium-4 aatomituumadest (nimetatakse ka α-osakesteks).
- keskmise läbitungimisvõimega kiirgust (teda peatab 2..3 mm paksune alumiiniumleht) hakati nimetama β-kiirguseks. See käitub magnetväljas nagu negatiivselt laetud osakeste voog. Tehti kindlaks, et β-kiirgus koosneb elektronidest (nimetatakse ka β-osakesteks).
- kõige suurema läbitungimisvõimega kiirgust (1cm paksune plii kiht vähendab kiirguse intensiivsust kõigest kaks korda), hakati nimetama γ-kiirguseks. Magnetväli ei avalda tema kulgemisele mingit mõju. Selgus, et γ-kiirgus on väga väikese lainepikkusega (λ<10-11m) ja väga suure energiaga elektromagnetlaine.
Radioaktiivsed muundumised
Radioaktiivset kiirgust uurides tõdeti, et see kiirgus on hämmastavalt muutumatu, selle selle eraldumisega kaasneb märgatav energia eraldumine ning lõpuks, et radioaktiivset kiirgust kiirgav keemiline element muundub selle käigus teiseks elemendiks.
Inglise füüsik Frederick Soddy sõnastas niinimetatud nihkereeglid alfa- ja beetakiirguste kohta. Gammakiirgusega ei kaasne tuumalaengu muutumist.
Alfa-lagunemisel kaotab tuum kahekordse elementaarlaengu suuruse positiivse elektrilaengu ning tema mass väheneb ligikaudu nelja aatommassi ühiku võrra ![]() isotoobi tuum nihkub perioodilisuse süsteemis kahe ruudu võrra ettepoole:
isotoobi tuum nihkub perioodilisuse süsteemis kahe ruudu võrra ettepoole:
Beeta-lagunemisel lendab tuumast välja elektron, mille tõttu tuumalaeng suureneb ühe ühiku võrra, tuuma mass aga jääb samaks ![]() isotoobi tuum nihkub ühe ruudu võrra perioodilisuse süsteemi lõpu poole:
isotoobi tuum nihkub ühe ruudu võrra perioodilisuse süsteemi lõpu poole:
Tõepoolest, beeta-lagunemisel lendab elektron välja aatomituumast.
Nimelt võime neutronit teatud olukorras käsitleda kui prootonist ja elektronist koosnevat liitosakest, mis sobivatel tingimustel laguneb prootoniks ja elektroniks. Prooton jääb tuuma, suurendades selle järjekorranumbrit, elektron aga paisatakse tuumast välja. Veelgi täpsemalt selgitades muutub teatud protsesside käigus üks neutronis sisalduv d-kvark u-kvargiks ning lisaks elektronile vabaneb veel ka elektronneutriino.
Stabiilsed tuumad
Radioaktiivseid isotoope on oluliselt enam kui stabiilseid – seega on tuuma stabiilsus pigem erand kui reegel.
Selleks, et tuum saaks olla stabiilne peab olema täidetud kolm tingimust:
- Kuna tuuma suurus on piiratud, siis peab leiduma optimaalne osakeste arv, et tuuma seoseenergia oleks antud tingimustes minimaalsed;
- Prootonite ja neutronite energiatasemed peavad olema täidetud alates madalaimast;
- Prootonite ja neutronite energiatasemed peavad olema täidetud võrdses ulatuses
Poolestusaeg
Radioaktiivsust uurides avastati, et iga radioaktiivse isotoobi jaoks on olemas kindel aeg – poolestusaeg – mille jooksul tema kiirguse intensiivsus väheneb poole võrra. Poolestusaja vältel jõuavad ära laguneda keskmiselt pooled ainekoguses sisaldunud radioaktiivse isotoobi tuumad.
Teades isotoobi poolestusaega τ ning tuumade arvu vaatluse alghetkel N0, saame leida lagunemata radioaktiivsete osakeste arvu N aja Δt möödudes valemist – radioaktiivse lagunemise seadusest:
Poolestusaeg on statistiline suurus – ta ei ütle midagi konkreetse osakese eluea kohta.
Mõnede isotoopide poolestusajad: vesinik-3 (triitium) – 12,3 aastat; süsinik-14 – 5730 aastat; radoon-222 – 3,825 päeva; uraan-238 – 4,5 mld aastat; plutoonium-239 – 24 400 aastat.
Mida lühem on poolestusaeg, seda intensiivsemat kiirgust see isotoop põhjustab ning seda suuremat ohtu kujutab ta inimeste tervisele. Samas väheneb lühikese poolestusajaga isotoopidega saastatud piirkonnas radioaktiivsuse tase kiiresti ning selle taaskasutusele võtmiseks kulub oluliselt vähem aega kui pika poolestusajaga isotoopide korral.
Radioaktiivne dateerimine
Poolestusaja uurimisel põhineb orgaanilise aine radioaktiivse dateerimise meetod.
Eluslooduses toimub pidev süsinikuringe. Kõik elusorganismid tarbivad ja eritavad süsinikku. Looduslik süsinik jaguneb isotoopide vahel järgmiselt: 98,89% looduses leiduvatest isotoopidest on stabiilsed süsinik-12 ja 1,11% süsinik-13 isotoobid, ülejäänud, alla 1% looduses esinevatest süsiniku isotoopidest (C-11, C-14, C-15) on radioaktiivsed ning nende tuumade esinemissagedus on Maal ja seetõttu ka kõikides elusorganismides fikseeritud alati kindlas proportsioonis.
Kui organism elab, siis on radioaktiivsete süsiniku isotoopide omastamine ja organismist väljutamine tasakaalus. Kui organism sureb, siis lakkab tema süsinikuvahetus – temas sisalduvad radioaktiivsed isotoobid küll lagunevad, kuid uusi radioaktiivseid isotoope ümbritsevast keskkonnast ei omistata. Süsinik-14 poolestusaeg on 5730 aastat, teistel radioaktiivsetel isotoopidel on see palju lühem. Nii võimaldab süsinik-14 isotoobi proportsiooni uurimine tuvastada mitu aastat tagasi lõppes orgaanilise aine osalemine süsinikuringes eh teisisõnu, millal uuritav süsinikukandja suri.
Radioaktiivse süsiniku meetod vähem kui 1%-lise täpsusega teha kindlaks, millal uuritav objekt süsinikuringest lahkus ehk suri. Meetod ei sobi hästi mõnikümmend või mõnisada aasta aastat tagasi surnud organismide vanuse dateerimiseks, kuid kui uurime mõni tuhat või koguni mõni miljon aastat tagasi elanud organismide jäänuseid, on radioaktiivse dateerimise meetod asendamatu abivahend leitud jäänuste vanuse kindlaks tegemisel.
Kiirgusdoos
Radioaktiivse kiirguse ohtlikus organismidele oli teada peaaegu selle avastamisest alates. 20. sajandi jooksul lisandus sellele ebamäärasele ohule teadmine, et radioaktiivne kiirgus põhjustab vähki (kantserogeenne toime) ning geneetilisi mutatsioone järglastel.
Tegelikult peame selle eest, et elu Maal üldse olemas on, tõenäoliselt samuti tänama radioaktiivset kiirgust, sest tänu maapinnas leiduvate radioaktiivsete isotoopide pidevale lagunemisele, asub kogu elusloodus pidevas kiirgusvoos.
Neid kiirgusliike, mis võivad otseselt surmata rakke, muuta nende DNA-d või tekitada muid kahjustusi, nimetatakse ioniseerivateks kiirgusteks.
Ioniseeriva kiirguse koguse – kiirguse doosi – mõõtmiseks kasutatakse ühikuna greid (1Gy). Neeldunud kiirgusdoos on võrdne ühe greiga, kui keha ühes kilogrammis neeldub 1 džaul kiirgusenergiat:
Kiirguse mõju elusorganismile kirjeldatakse ekvivalentdoosiga, mida mõõdetakse siivertites (1Sv). Ka siivert kirjeldab ühes kilogrammis elusorganismis neeldunud kiirgusenergia kogust džaulides, kuid kiirguse doosi korrigeeritakse faktoriga, mis arvestav liikide eripära ja muid üksikasju.
Kuna saadud kiirgusdoos kumuleerub – eelnevalt omandatud doosile liitub pidevalt juurde saadav doos, siis loetakse inimesele ohutuks loetakse kiirgusdoos, mis ei tohi ületada 100 mSv viie järjestikkuse aasta jooksul kumuleeruvana või 50 mSv aastas. Surmavaks loetakse ühekordset doosi 3…5 Sv, kiiritustõbi tekib ekvivalentdoosiga 1…3 Sv.
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!