3. Keemilise reaktsiooni tunnused ja esilekutsumine
MIKS ON VAJA TEADA KEEMILISE REAKTSIOONI
TUNNUSEID JA ESILEKUTSUMISE VÕIMALUSI?
Keemilised reaktsioonid kulgevad pidevalt nii meis endis kui ka looduses, neid kasutatakse tööstuses ja olmes. Kas Sa oskad märgata, milline looduses toimuv muutus on keemiline, millised reaktsioonid toimuvad koduses majapidamises? Seepärast õpimegi reaktsioone esile kutsuma, märkama nende kulgemist ja sellest järeldusi tegema.
KUIDAS LIIGITATAKSE LOODUSNÄHTUSI?
Samamoodi nagu ainete omadusi liigitatakse füüsikalisteks ja keemilisteks omadusteks, saab liigitada ka looduses toimuvaid muutusi ehk nähtusi.
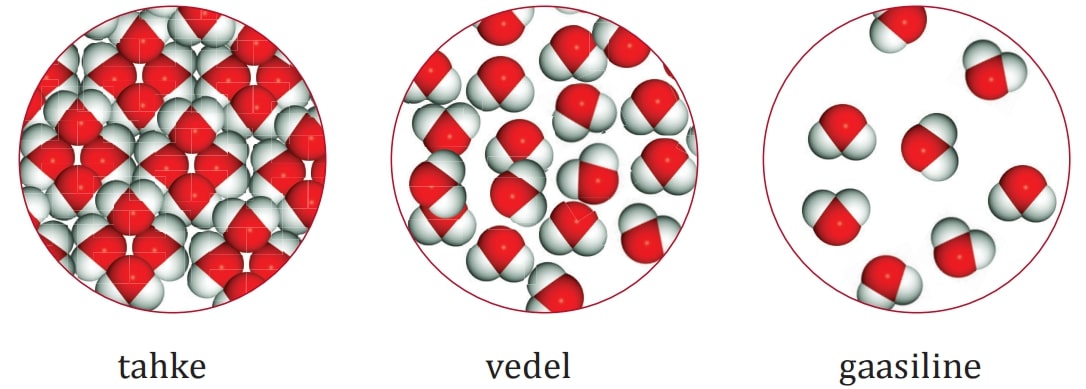
Füüsikaliste nähtuste korral võib ainega toimuda erinevaid muutusi (oleku või kuju muutus vms), kuid aineosakesed ise jäävad samaks. Näiteks vee aurumisel muutub vee olek vedelast gaasiliseks, kuid aine osakesed on endiselt vee molekulid. Ka jäätüki purustamisel pisikesteks kristallideks jäävad vee molekulid terveks.

Juhtides aga veest läbi elektrivoolu, toimub keemiline reaktsioon ehk tekivad uued ained – vee molekulid lagunevad vesiniku ja hapniku molekulideks.
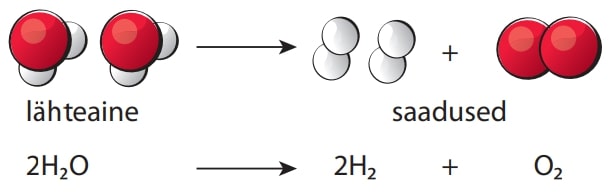
Keemiliste nähtuste ehk keemiliste reaktsioonide käigus muunduvad esialgsed ained ehk lähteained uuteks aineteks ehk saadusteks.
KUIDAS LIIGITATAKSE AINETE OMADUSI?
Ainele iseloomulikke tunnuseid nimetatakse aine omadusteks. Igal puhtal ainel on kindlad omadused, mis võimaldavad aineid üksteisest eristada. Aine omadused määravad vastava aine kasutusvõimalused.
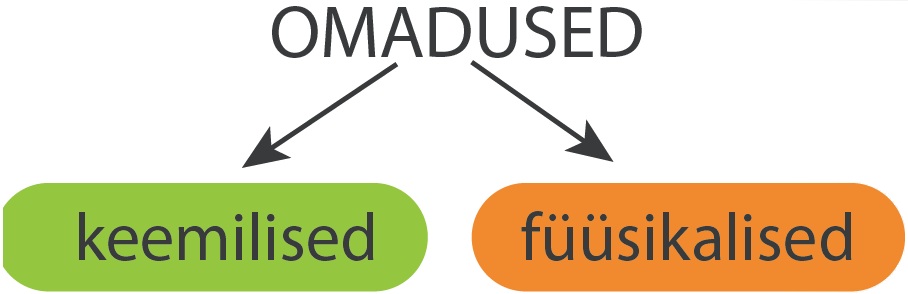
Keemilised omadused iseloomustavad aine reageerimisvõimet teiste ainetega. Keemiliste omaduste hulka kuuluvad näiteks aine võime põleda, reageerida veega jms.
Füüsikalised omadused pole seotud aine muundumisega teisteks aineteks. Olulisemad füüsikalised omadused on aine värvus, lõhn, sulamistemperatuur, keemistemperatuur, kõvadus, tugevus, elektrijuhtivus, soojusjuhtivus, lahustuvus erinevates lahustites, tihedus jt. Kui aine värvuse ja lõhna saame määrata oma meeleorganite (silmade ja nina) abil, siis ülejäänud omaduste iseloomustamiseks tuleb kasutada katsete või mõõtmiste abi.
KUIDAS TUNDA ÄRA KEEMILISE REAKTSIOONI TOIMUMIST?
Kuna keemiliste reaktsioonide käigus tekivad uued ained, millel on teistsugused omadused kui lähteainetel, siis on sageli juba väliste omaduste muutumise järgi võimalik keemilist reaktsiooni ära tunda. Ka kaasneb keemilise reaktsiooniga sageli märgatav soojusefekt.
Keemilise reaktsiooni tunnuseks võib olla:
- sademe (lahustumatu aine) teke või kadumine,
- gaasi (mullide) eraldumine,
- lõhna muutus,
- värvuse muutus,
- soojuse ja/või valguse eraldumine.

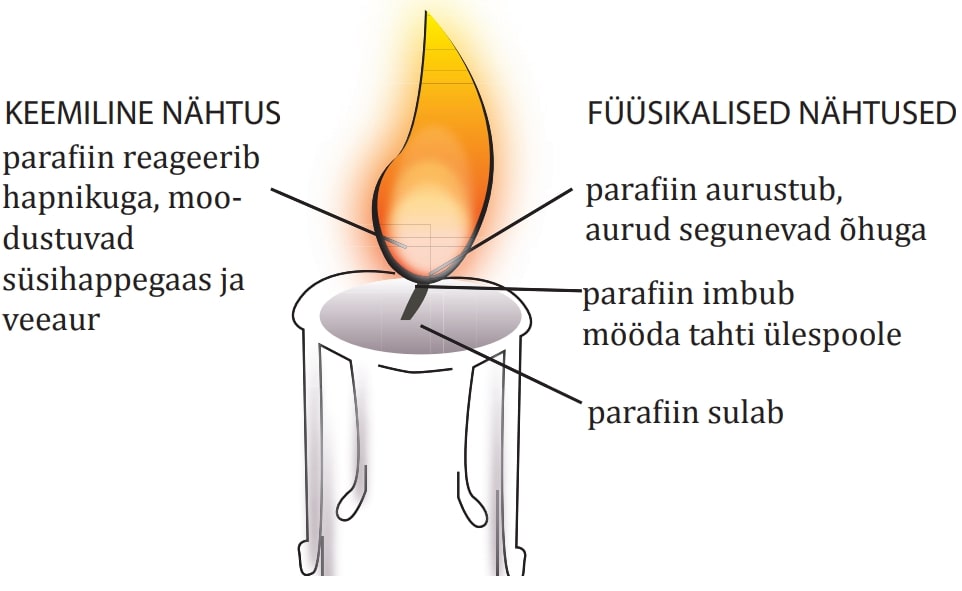
Keemilise reaktsiooni käigus toimub lähteainete koostisse kuuluvate aatomite ümberpaigutumine – saadused tekivad samadest aatomitest, millest koosnevad lähteained. Aatomite arv ja liik keemilise reaktsiooni käigus ei muutu. Seetõttu on reaktsiooni lähteainete mass võrdne reaktsioonisaaduste massiga. Näiteks küünla põlemisel lagunevad süsiniku ja vesiniku aatomitest koosnevad parafiini molekulid ning süsiniku ja vesiniku aatomid moodustavad ühinemisel õhuhapnikuga süsihappegaasi ja vee molekulid.
Samas tuleb silmas pidada, et keemilise reaktsiooniga kaasneb tavaliselt ka füüsikalisi nähtusi. Näiteks küünla põlemine on küll keemiline reaktsioon, kuid sellega kaasnev parafiini sulamine, imbumine mööda tahti, aurustumine ja auru segunemine õhuga on füüsikalised nähtused, parafiini ja hapniku muundumine süsihappegaasiks ja veeauruks aga keemiline.
KUIDAS KEEMILISI REAKTSIOONE ESILE KUTSUDA?
Selleks, et keemiline reaktsioon üldse toimuda saaks, peavad reageerivad ained omavahel kokku puutuma. Vahel võib olla tegu ka sellise reaktsiooniga, millel on vaid üks lähteaine, kuid sel juhul on reaktsiooni toimumiseks vaja mingit muutust tingimustes, näiteks ainet kuumutada. Ainete kuumutamine võib olla vajalik ka mitme lähteaine korral. Samas piisab sageli vaid ainete süütamisest, edasi kulgeb reaktsioon juba muundumise käigus eralduva soojuse arvelt (nt põlemisprotsessid).
Katsete läbiviimisel tuleb arvestada, et sageli võib keemiline reaktsioon olla aeglane. Selle kiirendamiseks saab kasutada kuumutamist. Reageerivate ainete parema kokkupuute tagab segamine ja tahkete ainete peenestamine.
Valguse toimel kulgeva reaktsiooni näiteks on taimedes toimuv fotosüntees. Elektrivoolu toimel saab toota metalle ja laadida akut (pane tähele, et nii aku laadimisel kui voolu andmisel kulgevad keemilised reaktsioonid).
Kokkuvõte
- Keemiliste reaktsioonide korral toimub lähteainete muundumine teisteks aineteks ehk saadusteks.
- Ained erinevad omaduste poolest. Keemilised omadused iseloomustavad aine osalemist keemilistes reaktsioonides, füüsikalised omadused ei ole seotud aine muundumisega.
- Keemilise reaktsiooni tunnuseks võib olla sademe (lahustumatu aine) teke või kadumine, gaasi eraldumine, lõhna muutus, värvuse muutus, soojuse ja valguse eraldumine.
- Keemilise reaktsiooni esilekutsumiseks peavad lähteained omavahel kokku puutuma, võib olla vajalik kuumutamine, süütamine, valgustamine või elektrivoolu läbijuhtimine.
SELLE ÕPPETÜKI LÄBIMISE JÄREL PEAKSID…
- teadma keemiliste reaktsioonide esilekutsumise võimalusi;
- tundma ära reaktsiooni toimumist iseloomulike tunnuste järgi.