Molekulaarjõud
Kui molekulid satuvad teineteisele piisavalt lähedale, hakkavad nende vahel mõjuma tõmbejõud. Tõmbejõudude tekkepõhjuseks on molekulide polaarsus – elektrilaengute ebaühtlane jaotumine molekulis.
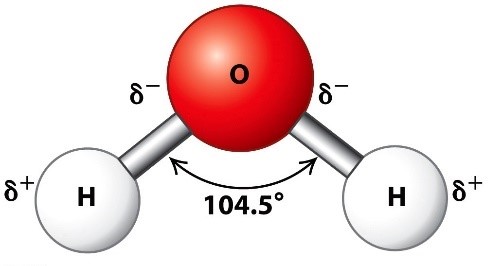
Ehkki aatomid ja molekulid on tervikuna elektrilaenguta, on molekulides (ja aatomites) piirkondi, kus on ülekaalus elektronide negatiivne laeng, seetõttu peavad olema molekulides ka piirkonnad, kus on ülekaalus positiivne laeng.
Sulle võivad huvi pakkuda need õppematerjalid:
Algebralised murrud
Tähestik, tähestikuline järjekord, häälikute jagunemine
Minni Aia-Utsal. Tõhusad enesekohased ja sotsiaalsed oskused
Õpime tähti. D-täht
Harjutusülesandeid matemaatika riigieksamiks
Õpime tähti. Õ-täht
Funktsioonide graafikute lõikepunktide leidmine
Protsendid põhikooli matemaatikas
Kuidas ja miks saada Ameerika presidendiks?
Ruutvõrrandi abil lahenduvad tekstülesanded
Eesti keele grammatika kordamine 7. klassile
xy-koordinaatsüsteem
Liitmine 10 piires
Aatomid ja molekulid
Õpime tähti. T-täht
Ilmekaim näide on veemolekul (joonisel) – kus hapnikuaatom (ioon) kannab endas negatiivset laengut, vesinikuaatomid (ioonid) aga positiivset.
Loomulikult hakkavad teineteise lähedusse sattunud erinimelised laengud tõmbuma, samanimelised aga tõukuvad – veemolekulide vahel moodustuvad vesiniksidemed. Taoliste sidemete olemasolu ongi vee eriliste keemiliste ja füüsikaliste omaduste põhjustajaks. Vesiniksidemed tekivad ka vesiniku ühendites koos lämmastiku (-NH) ja fluoriga (-FH).
Molekulide vahel mõjuvaid jõudusid nimetatakse ka nende avastaja Johannes Diderik van der Waals’i auks van der Waals’i jõududeks.
Vahemaad, millest suuremate kauguste korral molekulaarseid jõudusid ei teki – van der Waals’i jõudude mõjuraadius – on erinevate molekulide jaoks erinev, kuid jääb tavapäraselt suurusjärku sadakond pikomeetrit (1pm=10-12m)
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!