Leelismetallid
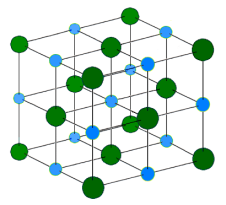
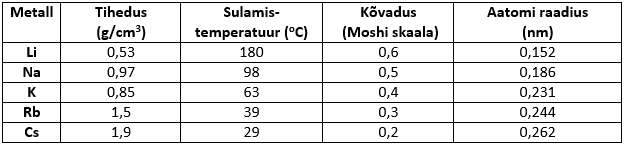
Leelismetallid on IA rühma metallid. Nimetus tuleneb sellest, et veega reageerides moodustavad nad leeliseid (vees lahustuvaid aluseid). Leelismetallid on väga aktiivsed metallid. Kuna metallilised omadused suurenevad rühmas ülevalt alla liikudes, siis on kõige aktiivsem metall frantsium. Kuna frantsiumil puuduvad stabiilsed isotoobid ning lihtainena teda praktiliselt ei esine, siis lihtainena võime lugeda kõige aktiivsemaks metalliks tseesiumi.
Sulle võivad huvi pakkuda need õppematerjalid:
Tutvus keemiaga
Lahused
Oksüdatsiooniaste
Растворы
Ioonid
Атомы и молекулы
Ионы
Знакомство с химией
Aatomid ja molekulid
Looduses leidub leelismetalle ühenditena, kuna lihtainena on nad väga aktiivsed. Kõige tuntum leelismetalliühend on naatriumkloriid ehk keedusool.
Füüsikalised omadused
Keemilised omadused
Leelismetallid on väga aktiivsed metallid. Nad reageerivad juba toatemperatuuril halogeniididega ja väävliga. Vesinikuga toimub reaktsioon kuumutamisel ning tekivad hüdriidid – ühendid, kus vesiniku oksüdatsiooniaste on -1. Veega reageerivad leelismetallid väga aktiivselt ning reaktsiooni käigus tekib leelis ja eraldub vesinik.
2Na + Cl2 = 2NaCl – kloriidi teke
2K + S = K2S – sulfiidi teke
2Li + H2 = 2LiH – hüdriidi teke
Kuna leelismetallid reageerivad ka hapnikuga, siis hoitakse neid metalle õlis, kuna õhu käes seistes reageerivad nad õhuhapnikuga. Hapnikuga reageerides tekib oksiid ainult liitiumi puhul, teiste leelismetallidega tekivad peroksiidid või hüperoksiidid.
4Li + O2 = 2Li2O – tekib oksiid
2Na + O2 = Na2O2 – tekib peroksiid
K + O2 = KO2 – tekib hüperoksiid
Sooladega reageerides leelismetallid teist metalli tema lahusest välja ei tõrju. Põhjus seisneb selles, et leelismetallid on väga aktiivsed ning kõigepealt reageerivad nad veega ning seejärel reageerib tekkinud leelis soolaga. Näiteks toimuvad naatriumi ja vasksulfaadi lahuse vahel järgmised reaktsioonid
2Na + 2H2O = 2NaOH + H2
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
Tuntumad ühendid
Naatriumkloriid ehk keedusool (NaCl). Üks tuntumaid leelismetallide ühendeid, mida kasutatakse toiduvalmistamisel ning samuti meditsiinis füsioloogilise lahuse valmistamiseks. Tööstuses on naatriumkloriid naatriumi ja kloori tootmise lähteaineks.
Naatriumhüdroksiid ehk seebikivi (NaOH). Üks peamisi leeliseid, mida kasutatakse paljudes puhastusainetes ning keemiatööstuses.
Kaaliumkloriid (KCl) on üks tähtsamaid kaaliumiühendeid. Põllumajanduses kasutatakse seda kaaliumiväetisena. Keemiatööstuses on kaaliumkloriid väga tähtsaks lähteaineks teiste kaaliumiühendite tootmisel.
Naatriumvesinikkarbonaat ehk söögisooda (NaHCO3) leiab kasutust toiduainetööstuses kergitusainena kuna hapetega reageerides tekib gaasiline CO2.
Naatriumkarbonaat ehk pesusooda (Na2CO3) on kasutusel puhastusvahendites. Kasutatakse ka klaasi ja paberitööstuses.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!