Keemiline side. Molekulid ja kristallid
Looduses esineb üksikuid aatomeid vähe, vaid väärisgaasid esinevad gaasilises olekus üksikute aatomitega. Aatomid tahavad saavutada väärisgaasidega sarnast elektronkatte ehitust – väliskihile kaheksat elektroni. Enamasti ühinevad aatomid omavahel, moodustades püsivamaid osakesi. Osakesi seob omavahel eriline vastastikmõju, mida nimetatakse keemiliseks sidemeks.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Растворы
Oksüdatsiooniaste
Атомы и молекулы
Tutvus keemiaga
Знакомство с химией
Ионы
Ioonid
Aatomid ja molekulid
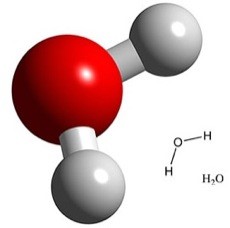
Püsivamad aatomite osakesed võivad olla erinevad. Aatomid võivad moodustada molekule. Ühe ja sama aine molekulid on alati ühesugused. Näiteks vee molekul on H2O – vee molekulis on omavahel seotud kaks vesiniku aatomit ja üks hapniku aatom.
Kõikidel ainetel ei ole olemas molekule. Näiteks metallides on kõik metalli aatomid omavahel korrapäraselt seostunud. Selliseid moodustisi nimetatakse kristallideks. Kristallide korrapärast siseehitust nimetatakse kristallvõreks. Metallide korral nimetatakse metalli aatomite korrapärast ehitust metallvõreks. Kristalle võivad moodustada ka mõned mittemetallid, näiteks süsinik. Teemat on väga püsiv ja tugev materjal, kuna seal on kõik süsiniku aatomid omavahel korrapäraselt seotud (iga süsinik on seotud nelja naabersüsinikuga). Teemanti korral nimetatakse kristallvõre ehitust aatomvõreks – kuna kristallvõre moodustavad aatomid.
Kovalentne side (ing):
Iooniline side (ing):
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!