Metallilised elemendid
Enamus meile tuntud elementidest on metallilised (praeguseks teatakse 92 metallilist elementi). Metallide ühiseks omaduseks on see, et neil on välisel elektronkihil vähe elektrone ning seetõttu nad keemilistes reaktsioonides loovutavad elektrone ning ühendites on metallid positiivse ioonina.
A-rühmades võrdub metalli väliskihi elektronide arv rühmanumbriga. B-rühmades on metallides enamasti väliskihis kaks elektroni (mõnel elemendil ka üks elektron).
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Знакомство с химией
Aatomid ja molekulid
Oksüdatsiooniaste
Атомы и молекулы
Tutvus keemiaga
Растворы
Ioonid
Ионы
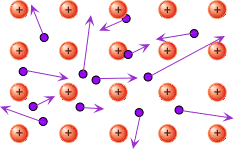
Metallides saavad väliskihi elektronid liikuda – nad ei ole kindlalt seotud ühe aatomiga, vaid võivad liikuda ühe aatomi juurest teise juurde. Kõik metallide tüüpilised omadused ongi tingitud sellest, et väliskihi elektronid saavad vabalt liikuda. Väliskihi elektronide vaba liikumist nimetatakse ka „elektrongaasiks“.
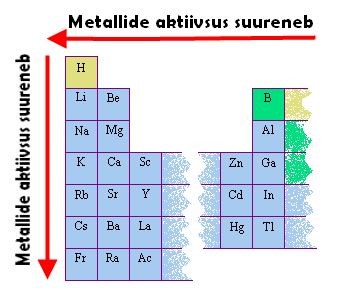
Metallide aktiivsus sõltub sellest, kui kergesti aatom elektrone loovutab. Metallide aktiivsus kasvab rühmas ülevalt alla, kuna siis elektronkihtide arv suureneb ning aatomituum hoiab elektrone nõrgemalt kinni. Perioodis kahaneb metalli aktiivsus vasakult paremale, kuna elektronkihtide arv aatomis jääb samaks, aga tuumalaeng suureneb, seega hoiab aatomituum elektrone tugevamalt kinni.
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!