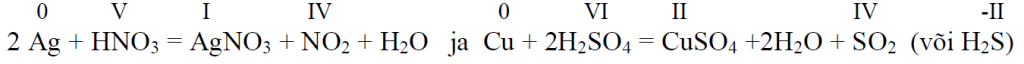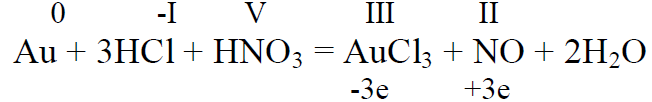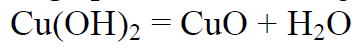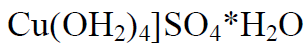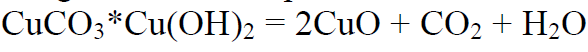I b rühm: Vask, hõbe, kuld
Tegemist on väheaktiivsete metallidega. Oks.astmed on muutuvad, kuid põühiliselt on tegemist Cu(II) , Ag(I) ja Au(III) ühenditega.
Kuumutamisel reageerivad mitmete mittemetallidega, eeskätt halogeenidega
Vask(II)kloriid – vase puhul pole oks.astme II näitamine kohustuslik
hõbebromiid – oks.astet I pole vaja näidata
kuld(III)fluoriid – ka siin piisaks kuldfluoriidist
*erandid
on oksüdeerija ja I- redutseerija, seetõttu
koos ei püsi ja vastavates reaktsioonides tekib vask(I)jodiid
* Hõbedaga annab fluor hõbe(II)fluoriidi, mis on enam vähem ainus püsiv Ag(II) ühend. AgF2 on ka ainus vees lahustuv hõbeda halogeniid.
Hapnikuga. Kuld ja hõbe vahetult ei reageeri. Vasega tekib alguses punakas vask(I)oksiid, mis hiljem oksüdeerub edasi mustaks vask(II)oksiidiks.
Väävliga. Ootamatult hästi reageerib väävliga hõbe (hapnikuga hõbe vahetult ei regeeri). Õhus ja toidus olevate väävliühendite toimel tekkib hõbeesemete pinnale musta Ag2S õhuke kelme. Eemaldada saab teda ammoniaakveega ( NH3) või naatriumtiosulfaadi (Na2S2O3 ) lahusega.
Pingereas paiknevad lõpus seega
– Veega ei reageeri
– Hapetest vesinikku välja ei tõrju ***
– Soolade lahustest tõrjuvad metalle välja vastavalt pingereale
– Leelistega ei reageeri
*** Vask ja hõbe reageerivad lämmastikhappega ja kuuma kange väävelhappega, sest antud tingimustel on nitraatioon ja sulfaatioon on vesinikioonist tugevamad oksüdeerijad
Kuld lämmastikhappega ei reageeri , lahustub kuningvees
kasut. ka valemit
Õhuhapniku juuresolekul lahustub kuld ka KCN vesilahuses, seda kasutatakse kulla eraldamiseks maakidest.
Tähtsamad ühendid
Oksiidid:
vask(I)oksiidi (punane) – saab vask(II)ühendite redutseerimisel näiteks aldehüüdidega
(aldehüüdrühma tõestusreaktsioon)
Omadustelt on ta aluseline oksiid
Väävelhappega tekib vask(II)sulfaat, sest vask(I)sulfaat on ebapüsiv
Kuumas ja kanges happes on võimalik ka
Vask(II)oksiid (must) põhiliselt aluseline oksiid, mis ei reageeri veega. Reageerib hapetega
Leelistega praktiliselt ei reageeri. Saada on kõige lihtsam vastavast hüdroksiidist
Hõbeda ja kulla oksiid on tähtsusetud
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Tutvus keemiaga
Oksüdatsiooniaste
Растворы
Знакомство с химией
Ионы
Атомы и молекулы
Ioonid
Õpime tähti. Z- ja Ž-täht
Aatomid ja molekulid
Hüdroksiidid
Vask(I)hüdroksiid
või lihtsustatult
kollane , vees lahustumatu, kuid selgelt aluseliste omadustega aine. Saab vastavatest sooladest
Vask(II)hüdroksiid sinine sültjas sade, mida saab vask(II)soola tõõtlemisel leelisega
Keemilistelt omadustelt ülekaalukalt aluseliste omadustega. Reageerib hästi hapetega, kuid leeliste suhtes on enam vähem püsiv. Lahustub ammoniaagi vesilahuses, andes erksalt lillakassinise vask(II)tetraaminohüdroksiidi (Szchweitzeri reaktiiv) lahuse. Reaktsioon sobib Cu2+ ja ammoniaagi tõestamiseks.
Kulla ja hõbeda hüdroksiide ei tunta. Nende asemel tekivad vastavad oksiidid
niiske hõbeoksiid värvib punase lakmuse siniseks, seega on hüpoteetiline AgOH üsna tugev alus.
Halogeniidid olulisemad on fotograafias kasutatavad hõbedasoolad, eriti AgBr. Vees hõbedahalogeniidid ei lahustu (va AgF2) ja lahusesse saab neid viia ammoniaagi vesilahuse või naatriumtiosulfaadi lahuse abil (fotokinnisti). Hõbeda koordinatsiooniarv on 2 – teistel metallidel on ta suurem ( tavaliselt 4 või 6)
ja
Ühel juhul läheb hõbe komplekskatiooni (diaminohõbe) , teisel juhul kompleksaniooni (tiosulfatoargentaat) koostisse.
Sulfaatidest tähtsam
õigemini
Malahiit
vaskkarbonaatdihüdroksiid
roheline neerumustriga poolvääriskivi ja vasemaak. Enam vähem sama koostisega on ka sinine poolvääriskivi asuriit.
Kuumutamisel laguneb
Nitraatidest on olulisem soolatüügaste söövitamiseks kasutatav põrgukivi. Kuna hõbeoksiid on termiliselt ebapüsiv, siis selle soola lagundamisel tekib vaba metall
Kulla nitraadid on tähtsusetud, Vask(II)nitraat laguneb nii nagu enamus nitraatidest
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!