Kovalentne side
Kovalentne side esineb aatomituumade vahel, mis jagavad üht või mitut ühist elektronpaari. Kovalentne side esineb kahe sama või erineva mittemetalli aatomite vahel.
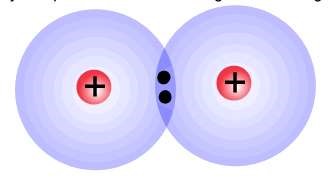
Kahe sama elementi aatomite vahel olevat kovalentset sidet nimetatakse mittepolaarseks kovalentseks sidemeks. Sellisel juhul asub ühine elektronpaar täpselt kahe aatomi vahel.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Tutvus keemiaga
Растворы
Ioonid
Знакомство с химией
Aatomid ja molekulid
Oksüdatsiooniaste
Атомы и молекулы
Ионы
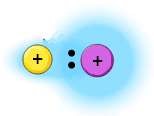
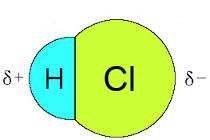
Kahe erineva mittemetalli vahel esinevat kovalentset sidet nimetatakse polaarseks kovalentseks sidemeks. Sellisel juhul on ühine elektronpaar nihutatud selle aatomi poole, mis on mittemetallilisem. Mittemetallilisem aatom (see kumma poole on elektronpaar nihutatud) saab seejuures negatiivse osalaengu ning teine aatom positiivse osalaengu. Osalaengud on väikesed laengud, mille aatomid saavad, kui ühine elektronpaar ei ole täpselt aatomite vahel.
Molekuli polaarsus
Lähtuvalt sellest, kas molekul sisaldab polaarseid või mittepolaarseid kovalentseid sidemeid jagatakse molekulid polaarseteks ja mittepolaarseteks. Kõik molekulid, milles esineb mittepolaarne kovalentne side on mittepolaarsed. Kui molekulides esineb polaarne kovalentne side, siis sõltub molekuli polaarsus sellest, kuidas aatomid üksteise suhtes ruumis paigutuvad. Kaheaatomiliste ühendite (nagu HCl, CO) on asi lihtne, kõik need ühendid on ka polaarsed – molekulil saab eristada negatiivse laenguga poolt ning positiivse laenguga poolt.
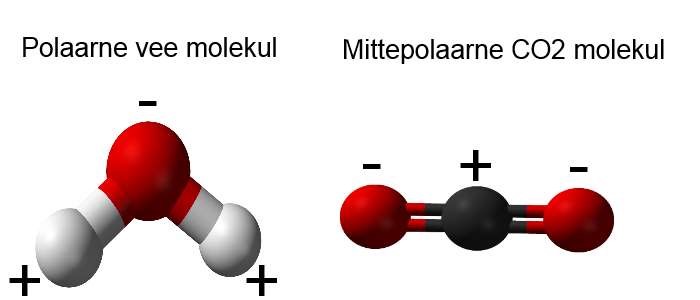
Kui molekul koosneb rohkem kui kahest aatomist, mille vahel on polaarne kovalentne side, siis võib molekul tervikuna olla nii polaarne kui mittepolaarne. See sõltub sellest, kuidas aatomid üksteise suhtes paigutuvad ning selle määramine vajab rohkem teadmisi elektronide paigutusest molekulis. Näiteks H2O molekul on polaarne, kuid CO2 molekul on mittepolaarne kuna lineaarse ehituse tõttu toimivad laengud vastassuundades ning tasakaalustavad teineteist.
Molekulaarsed ained
Enamasti on kovalentse sidemega ained molekulaarsed. See tähendab seda, et kovalentse sidemega seotud aatomid moodustavad molekuli. Näiteks on molekulaarsed ained H2O, CO2, C6H12O6, HCl.
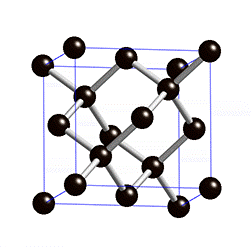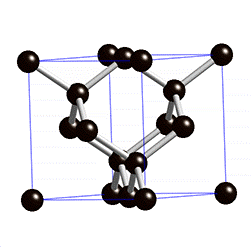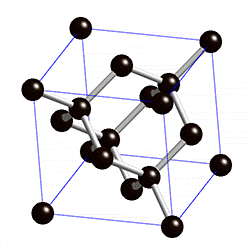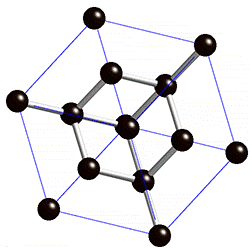
Kuid mõningatel juhtudel ei tähenda kovalentse sideme olemasolu molekulide moodustamist, vaid võivad tekkida korrapärased ruumilised struktuurid (kristallvõred), kus paljud aatomid on omavahel kovalentse sidemega seotud. Näiteks on kovalentse sidemega mittemolekulaarsed ained teemant ning ränidioksiid. Nendes ainetes on kõik aatomid omavahel kovalentsete sidemetega seotud ning neid kristallvõresid nimetatakse aatomvõredeks. Aatomvõrega ained on väga tugevad ning kõrge sulamistemperatuuriga ained, kuna kristallvõre lõhkumiseks tuleb lõhkuda väga tugevad sidemed (kovalentsed sidemed).
VIDEOD:
Kovalentne side (ing)
Kovalentse sidemega ained (ing)
Molekulaarsed tahkised (ing)
Kovalentne side on elektronpaari jagamine (ing)
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!