Keemilised vooluallikad
Keemilistes vooluallikates muudetakse keemilise reaktsiooni energia elektrienergiaks. Elektrivool tekib, kui elektronid (laetud osakesed) suunatult liiguvad, seega saab redoksreaktsioone panna käima nii, et selle tulemusena tekib elektrivool.
Keemilisi vooluallikaid on kahte liiki – galvaanielement ning kütuselement.
Sulle võivad huvi pakkuda need õppematerjalid:
Ioonid
Oksüdatsiooniaste
Tutvus keemiaga
Aatomid ja molekulid
Lahused
Ионы
Атомы и молекулы
Растворы
Знакомство с химией
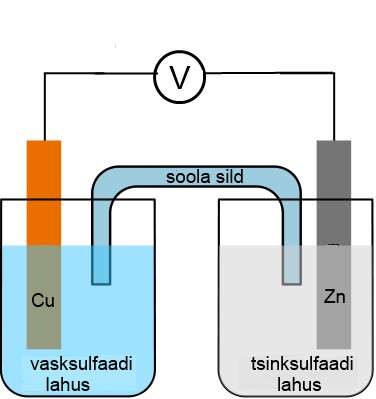
Kõige lihtsam galvaanielement on vask-tsink element. Vask elektrood on sukeldatud vasksulfaadi lahusesse ning tsink elektrood tsinksulfaadi lahusesse (vt joonis) ning lahused on omavahel ühendatud poorse vaheseinaga, millest ioonid saavad läbi liikuda. Kuna tsink on aktiivsem metall, siis hakkab tema oksüdeeruma ning loovutab elektrone, mis mööda juhet liiguvad vaskelektroodile, kus vaskioonid liidavad elektrone.
Galvaanielemente kasutatakse patareide ja akude valmistamisel. Aku erineb patareist selle poolest, et akut saab elektriga laadida – laadimise ajal toimuv keemiline reaktsioon on aku tühjenemise pöördreaktsioon. Auto akudena kasutatakse peamiselt pliiakusid, kus aku tühjenemisel tekib pliist ja pliioksiidist pliisulfaat ning aku laadimisel pliisulfaat laguneb tagasi pliiks ja pliioksiidiks. Elektrolüüdina kasutatakse pliiakus kontsentreeritud väävelhapet.
Pb + PbO2 + 2H2SO4 <=> 2PbSO4¯ + 2H2O
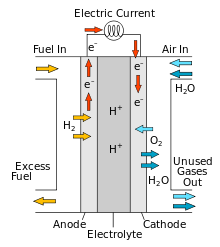
Kütuseelemendid erinevad galvaanielementidest selle poolest, et kütuseelementides antakse elektroodidele pidevalt kütust juurde. Üheks lihtsamaks kütuseelemendiks on vesinik-hapnik element, kus vesiniku oksüdeerumisel eraldunud energia muudetakse elektrienergiaks. Selline kütuseelement on väga loodussõbralik, kuna ainsa saadusena tekib puhas vesi.
Elektrokeemia (ing)
Keemiline vooluallikas (ing)
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!