Metallide keemilised omadused
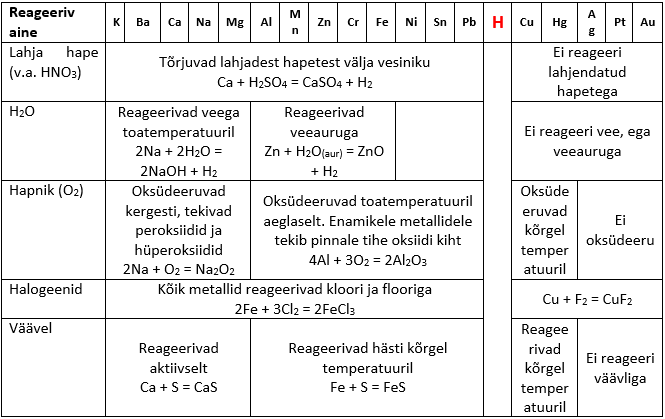
Metallide keemilised omadused sõltuvad metalli aatomiehitusest. Ühiseks omaduseks on see, et lihtainena käituvad kõik metallid redutseerijatena – metallid loovutavad elektrone. Kõik metallid on paigutatud aktiivsuse järgi metallide elektrokeemilisse aktiivsusritta – metallide pingeritta. Metallide pingerea põhjal saab kindlaks määrata mitmeid metallide omadusi:
Sulle võivad huvi pakkuda need õppematerjalid:
Aatomid ja molekulid
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Растворы
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Знакомство с химией
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Атомы и молекулы
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Tutvus keemiaga
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Ioonid
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Lahused
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Ионы
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Oksüdatsiooniaste
alates 3.90 €
8. klass, 9. klass, Iseõppijale, Keemia
Eelmine
Järgmine
- Aktiivsem metall tõrjub vähemaktiivsema metalli tema soola lahusest välja. Arvestada tuleb sellega, et metall ei tohi reageerida veega – veega reageerivad metallid teist soola välja ei tõrju, vaid kõigepealt toimub reaktsioon metalli ja vee vahel.
- Lahjendatud hapetega reageerivad need metallid, mis paiknevad pingereas vesinikust vasakul ning reaktsiooni käigus eraldub vesinik. Erandiks on lämmastikhape ning kontsentreeritud väävelhape, mis võivad reageerida ka vesinikust paremal olevate metallidega ning reaktsiooni käigus vesinikku ei eraldu. Lämmastikhape ja kontsentreeritud väävelhape reageerivad teistmoodi, kuna nad on tugevad oksüdeerujad.
Üldised metallide keemilised omadused on toodud allolevas tabelis:
Lisainfo
See artikkel on retsenseerimata.
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!