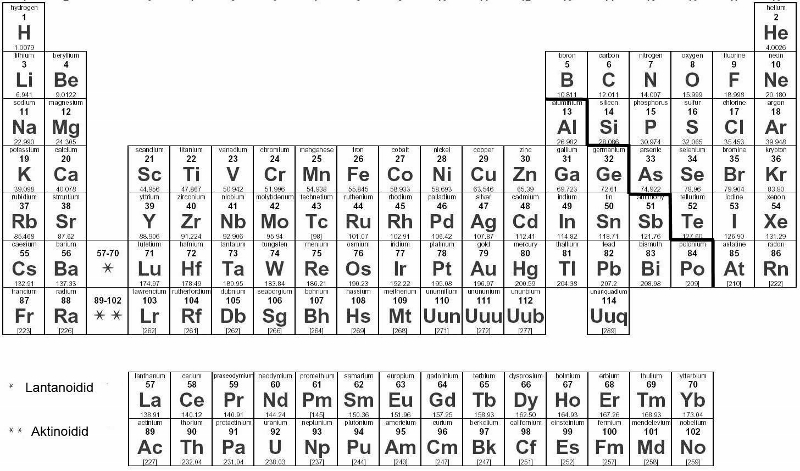
Perioodilisustabel
Keemilised elemendid on paigutatud perioodilisustabelisse aatomnumbri kasvamise järjekorras, kusjuures ühesuguste omaduste elemendid on samas tulbas (rühmas).
Järjenumber näitab prootonite arvu aatomituumas, tuumalaengu (aatomnumbri), elektronide arvu elektronkattes ning määrab ära selle, mis elemendiga on tegemist.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Атомы и молекулы
Знакомство с химией
Растворы
Ионы
Aatomid ja molekulid
Tutvus keemiaga
Oksüdatsiooniaste
Ioonid
Perioodinumber näitab seda, mitu elektronkihti on aatomis.
Rühma number (A rühmades) näitab ära selle, mitu elektroni on välisel elektronkihil.
Vastavalt sellele, milline alakiht (s, p, d, f) täitub viimasena elektronidega saab elemente jaotada s-elemenditeks, p-elementideks, d-elementideks ning f-elementideks.
s-elementidel on viimasena täitunud s-alakiht ning nad asuvad IA ja IIA rühmas. Välisel elektronkihil on neil üks või kaks elektroni, sõltuvalt sellest, millises rühmas element asub. s-elementidel saab olla ühendites ainult üks kindel oksüdatsiooniaste – o.a võrdub rühma numbriga.
p-elementidel on viimasena täitunud p-alakiht ning nad asuvad IIIA – VIIA rühmas. Välisel elektronkihil on neil kolm kuni kaheksa elektroni. Kõik mittemetallid on p-elemendid (mõned metallid on samuti p-elemendid). Mittemetalliliste p-elementide oksüdatsiooniaste saab olla erinev, omades nii positiivseid kui negatiivseid väärtusi.
d-elemendid asuvad B rühmades ning neil on viimasena (osaliselt) täitunud d-alakiht. Kõik d-elemendid on metallid ning neid metalle nimetatakse ka siirdemetallideks. Kuigi viimasena on neil elementidel täitunud d-alakiht, siis väliskihil on neil ikkagi enamasti 1-2 elektroni, kuna väliskihiks on neil s-alakiht, mitte d-alakiht (osaliselt täitunud d-alakiht on eelviimase elektronikihi alakiht). Näiteks raua elektronvalem on järgmine
Fe +26 | 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Väliskihiks on 4s alakiht, kus asub kaks elektroni, kuid osaliselt on elektronide täitunud eelviimase elektronikihi d-alakiht (3d), kus on kuus elektroni.
Osaliselt täitmata d-alakihi tõttu saab neil metallidel olla erinevaid positiivseid oksüdatsiooniastmeid kuna nad võivad elektrone ka nendelt alakihtidelt loovutada.
f-elemendid on teistsuguste omadustega ning need paigutatakse enamasti perioodilisustabeli alla omaette ridadena. f-elemente nimetatakse ka lantanoidideks ja aktiniodideks.
Omaduste muutused perioodilisustabelis
Liikudes rühmades ülevalt alla, elemendi metallilised omadused suurenevad. See on tingitud sellest, et elektronkihtide arv suureneb ning aatom saab kergemini elektrone loovutada. Meenutuseks, et mida kergemini element elektrone loovutav, seda metallilisem ta on. Rühmas olevalt alla liikudes aatomiraadius suureneb, kuna suureneb ka elektronkihtide arv.
Liikudes perioodis vasakult paremale, elemendi metallilised omadused vähenevad (mittemetallilised omadused suurenevad). Põhjus seisneb selles, et elektronkihtide arv jääb samaks (välised elektronid asuvad samal energianivool), kuid aatomi tuumalaeng suureneb, seega suudab aatom tõmmata elektrone tuumale lähemale ning neid on raskem loovutada. Perioodis vasakult paremale liikudes aatomiraadius väheneb, kuna tuumalaeng suureneb ning aatom tõmbab elektrone tuumale lähemale.
VIDEOD:
Perioodilisus (ing)
Keemiliste omaduste võrdlus samas grupis (ing)
Keemiliste omaduste muutus 3. Perioodis (ing)
Lisainfo
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!