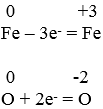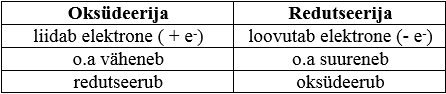Redoksreaktsioonid
Redoksreaktsioonid on keemilised reaktsioonid, mille käigus muutub elementide oksüdatsiooniaste. Redoksreaktsioon on näiteks metalli ja mittemetalli reageerimine hapnikuga. Raua oksüdatsiooni aste muutub nullist kolmeks ning hapniku oksüdatsiooniaste nullist miinus kaheks.
Redoksreaktsioonides ühe elemendi oksüdatsiooniaste suureneb ning teise elemendi o.a väheneb. Vastavalt sellele nimetatakse elemente (aineid) ka oksüdeerijaks ja redutseerijaks.
Sulle võivad huvi pakkuda need õppematerjalid:
Lahused
Знакомство с химией
Aatomid ja molekulid
Oksüdatsiooniaste
Атомы и молекулы
Tutvus keemiaga
Растворы
Ioonid
Ионы
Oksüdeerija on aine, mis liidab elektrone ning mille o.a väheneb
Redutseerija on aine, mis loovutab elektrone ning mille o.a suureneb
Kui aine reageerib oksüdeerijaga, siis see aine oksüdeerub ning aine, mis reageerib redutseerijaga redutseerub. Kuna redoksreaktsioonides on alati olemas oksüdeerija ja redutseerija, siis redutseerija oksüdeerub ning oksüdeerija redutseerub.
Eespool toodud näites:
On raud redutseerija, kuna tema loovutas elektrone (o.a suurenes) ning hapnik on oksüdeerija, kuna tema liitis elektrone ja tema o.a vähenes.
Kokkuvõtvalt võime oksüdeerija ja redutseerija omadused panna kirja tabelina:
Loe lisaks:
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!