PERIOODILISUSSÜSTEEM
Keemiliste elementide ning neist moodustunud ühendite omadused on perioodilises sõltuvuses aatomituuma laengust. Süsteemi, mille järgi on paigutatud tänapäeva keemilised elemendid nimetatakse keemiliste elementide perioodilisussüsteemiks ning need esitatakse keemiliste elementide perioodilisustabelina. Seda tabelit tuntakse ka kui Mendelejevi tabeli nime all, kuna Mendelejev oli esimene, kes leidis aatomite vahel perioodilised seosed ning paigutas need tabelisse.
Sulle võivad huvi pakkuda need õppematerjalid:
Растворы
Ионы
Знакомство с химией
Lahused
Oksüdatsiooniaste
Aatomid ja molekulid
Tutvus keemiaga
Ioonid
Атомы и молекулы
Perioodilisustabeli koostamisel on kindlad reeglid:
- Keemilised elemendid reastatakse tuumalaengu kasvu järgi
- Keemilised elemendid rühmitatakse sarnaste omaduste põhjal
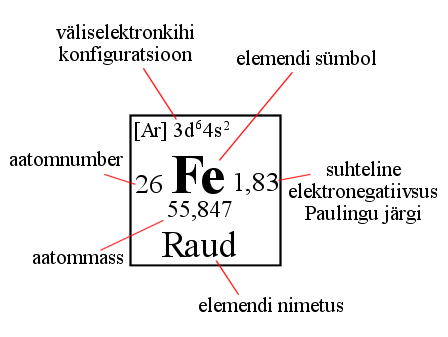
Tulenevalt nendest reeglites on perioodilisustabelis perioodid (vertikaalsed read) ja rühmad (tulbad) (vt joonis). Igas lahtris on välja toodud ühe elemendi iseloomulikud näitajad. Tavaliselt on nendeks: elemendi sümbol, nimetus, tuumaleng (järjekorranumber), aatommass.
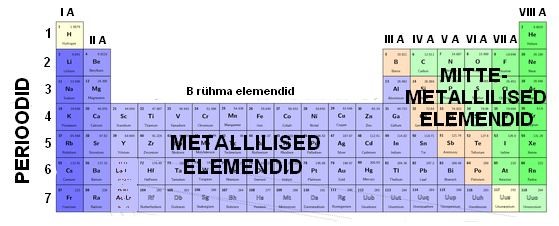
Enamus elemente on metallilised elemendid, ainult väike osa on mittemetallilised. Mittemetallilised elemendid paiknevad tabeli paremas ülemises nurgas.
Pildi allikasa: wikipedia
Elemendi järjenumber on tähtis suurus, kuna see näitab, mis elemendiga on tegemist. Järjenumber on arvuliselt võrdne elemendi tuumalaenguga, prootonite ja elektronide arvuga. Perioodilisustabeli periood näitab ära selle, mitmes elektronkihis elektronid paiknevad. Perioodilisustabeli rühma number (A-rühmades) näitab ära selle, mitu elektroni on aatomil väliskihil. Näiteks alumiinium asub kolmandas perioodis ja IIIA rühmas, seega on alumiiniumil kolm elektronkihiti ning väliskihil on 3 elektroni.
Perioodilisus (ing):
LOE LISAKS:
Keemiliste elementide perioodilisussüsteem ja selle ülesehitus
Lisaks:
Märkasid viga? Anna sellest teada ja teeme TaskuTarga koos paremaks!